题目内容
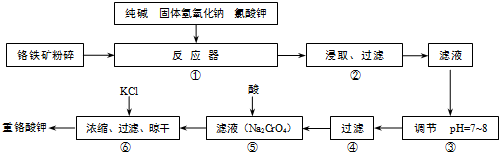
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO?Cr2O3)为原料生产重铬酸钾.实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图所示.反应器中涉及的主要反应是:
6FeO?Cr2O3+24NaOH+7KClO3
12Na2CrO4+3Fe2O3+7KCl+12H2O
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐.写出氧化铝与碳酸钠反应的化学方程式: .
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式: .
(3)步骤③中测定pH值的操作为: .
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
(5)称取重铬酸钾(其式量为294)试样2.5000g配成250mL溶液,用移液管取出25.00mL于碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需 和 .
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应) .(保留2位小数)
6FeO?Cr2O3+24NaOH+7KClO3
| ||

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐.写出氧化铝与碳酸钠反应的化学方程式:
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:
(3)步骤③中测定pH值的操作为:
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)
分析:(1)依据杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐写出化学方程式;
(2)酸化后CrO42-转化为Cr2O72-,依据原子守恒和电荷守恒写出离子方程式;
(3)依据PH试纸的使用方法分析回答;
(4)过量的酸溶液中反应生成沉淀说明是硅酸沉淀;加入过量氢氧化钠溶液反应生成红褐色沉淀氢氧化铁;偏铝酸盐通入过量二氧化碳反应生成白色沉淀为氢氧化铝;
(5)①依据溶液配制的步骤分析需要的玻璃仪器;
②根据反应:I2+2S2O32-=2I-+S4O62-,碘单质遇到淀粉时,溶液的蓝色消失,据此来回答并计算纯度.依据反应过程的离子方程式的定量关系计算,注意溶液体积变化;
(2)酸化后CrO42-转化为Cr2O72-,依据原子守恒和电荷守恒写出离子方程式;
(3)依据PH试纸的使用方法分析回答;
(4)过量的酸溶液中反应生成沉淀说明是硅酸沉淀;加入过量氢氧化钠溶液反应生成红褐色沉淀氢氧化铁;偏铝酸盐通入过量二氧化碳反应生成白色沉淀为氢氧化铝;
(5)①依据溶液配制的步骤分析需要的玻璃仪器;
②根据反应:I2+2S2O32-=2I-+S4O62-,碘单质遇到淀粉时,溶液的蓝色消失,据此来回答并计算纯度.依据反应过程的离子方程式的定量关系计算,注意溶液体积变化;
解答:解:(1)杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐,氧化硅和碳酸钠加热反应生成硅酸钠和二氧化碳,所以氧化铝和碳酸钠反应的化学方程式为:Al2O3+Na2CO3=2NaAlO2+CO2↑;
故答案为:Al2O3+Na2CO3=2NaAlO2+CO2↑;
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,转化的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O;
故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)PH试纸的实验方法是取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,变色后再将试纸与标准比色卡进行比较,
故答案为:取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,再将试纸与标准比色卡进行比较;
(4)检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验过程是利用过量盐酸反应能生成沉淀的是硅酸根离子,生成沉淀硅酸,剩余溶液中加入过量氢氧化钠溶液出现红褐色沉淀氢氧化铁,铝离子生成偏铝酸钠,在滤液中通入过量二氧化碳反应生成白色沉淀氢氧化铝;
故答案为:
(4)①配制溶液时,在烧杯中溶解物质后,盐玻璃棒转移溶液到250ml容量瓶中,最后用胶头滴管定容,所以所需的玻璃仪器除烧杯、玻璃棒外,还需250 mL容量瓶,胶头滴管;
故答案为:250 mL容量瓶,胶头滴管;
②根据反应:I2+2S2O32-=2I-+S4O62-,当滴加最后一滴硫代硫酸钠溶液时,碘单质恰好完全反应,溶液蓝色褪去,达到滴定终点,由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算.
Cr2O72-~3I2~6S2O32-
1mol 6mol
n 0.1200×40×10-3mol
则250ml含重铬酸钾的物质的量为n=
×10,则所得产品中重铬酸钾纯度为
×100%=94.08%;
故答案为:94.08%;
故答案为:Al2O3+Na2CO3=2NaAlO2+CO2↑;
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,转化的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O;
故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)PH试纸的实验方法是取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,变色后再将试纸与标准比色卡进行比较,
故答案为:取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,再将试纸与标准比色卡进行比较;
(4)检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验过程是利用过量盐酸反应能生成沉淀的是硅酸根离子,生成沉淀硅酸,剩余溶液中加入过量氢氧化钠溶液出现红褐色沉淀氢氧化铁,铝离子生成偏铝酸钠,在滤液中通入过量二氧化碳反应生成白色沉淀氢氧化铝;
故答案为:
| 硅酸(或H2SiO3) | ||
| NaOH溶液(或其它强碱溶液) | ||
| 白色胶状沉淀生成 |
故答案为:250 mL容量瓶,胶头滴管;
②根据反应:I2+2S2O32-=2I-+S4O62-,当滴加最后一滴硫代硫酸钠溶液时,碘单质恰好完全反应,溶液蓝色褪去,达到滴定终点,由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算.
Cr2O72-~3I2~6S2O32-
1mol 6mol
n 0.1200×40×10-3mol
则250ml含重铬酸钾的物质的量为n=
| 0.1200×40×10-3mol |
| 6 |
| 0.1200×40×10-3×10×294 |
| 6×2.5000 |
故答案为:94.08%;
点评:本题考查物质性质和组成的实验分析应用,有关盐的水解以及滴定实验等方面的综合知识,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目