题目内容
利用海水资源进行化工生产的部分工艺流程如图:
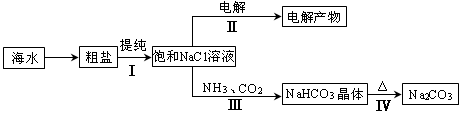
(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
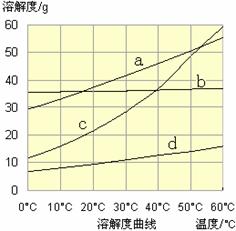
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。
(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2=" +473.63" kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。

(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。

(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2=" +473.63" kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
(16分)
(1)bd(3分,只选b或d得1分,全对得3分,凡其它有错答案不得分)。
(2) 2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分,写“通电”不扣分、漏反应条件、无“↑”、未配平只扣1分); Cl2(或氯气)(1分),增大(1分)
2OH-+H2↑+Cl2↑(2分,写“通电”不扣分、漏反应条件、无“↑”、未配平只扣1分); Cl2(或氯气)(1分),增大(1分)
(3)d (2分) NaCl + CO2 + NH3 + H2O="=" NaHCO3↓+ NH4Cl(2分,未写“↓”扣1分)
(4)蒸发浓缩 冷却结晶(2分) — 44.00 kJ/mol(3分,无单位扣1分,没有符号“-”的不得分)
(1)bd(3分,只选b或d得1分,全对得3分,凡其它有错答案不得分)。
(2) 2Cl-+2H2O
 2OH-+H2↑+Cl2↑(2分,写“通电”不扣分、漏反应条件、无“↑”、未配平只扣1分); Cl2(或氯气)(1分),增大(1分)
2OH-+H2↑+Cl2↑(2分,写“通电”不扣分、漏反应条件、无“↑”、未配平只扣1分); Cl2(或氯气)(1分),增大(1分)(3)d (2分) NaCl + CO2 + NH3 + H2O="=" NaHCO3↓+ NH4Cl(2分,未写“↓”扣1分)
(4)蒸发浓缩 冷却结晶(2分) — 44.00 kJ/mol(3分,无单位扣1分,没有符号“-”的不得分)
试题分析:(1)a项,虽然能除去杂质及过量碳酸钠和氢氧化钠,但是过量氯化钡没有除去,故a选项错误;b项,既能除去杂质及过量的氢氧化钠、氯化钡、碳酸钠,又不引入新的杂质,故b选项正确;c项,虽然能除去杂质及过量的氢氧化钠、碳酸钠,但是过量的氯化钡没有除去,故c选项错误;d项,既能除去杂质及过量的氯化钡、碳酸钠、氢氧化钠,又不引入新的杂质,故d选项正确;(2)用惰性电解饱和食盐水可以制备氢氧化钠、氢气、氯气,该反应实质为2Cl-+2H2O
 2OH-+H2↑+Cl2↑;阴离子移向阳极,氯离子比氢氧根离子容易失去电子,发生氧化反应,产生黄绿色的气体,即氯气;阳离子移向阴极,氢离子比钠离子容易得到电子,发生还原反应,则阴极产生无色气体,即氢气,由于氢离子被消耗,则阴极附近氢离子浓度减小,所以阴极附近溶液的pH增大;(3)流程III的反应属于复分解反应,即NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl(或者NH3+H2O==NH3?H2O、NH3?H2O+CO2==NH4HCO3、NH4HCO3+NaCl="=" NaHCO3↓+NH4Cl),该反应能够发生的原因是NH4HCO3、NaCl的溶解度均大于NaHCO3,则图中溶解度最小的d表示NaHCO3;(4)由于被提纯物和杂质都是可溶物,杂质可能是NaCl等,根据混合物分离提纯的方法推断,应选择结晶法分离出碳酸钠晶体,因此需要将碳酸钠样品加适量水溶解、蒸发浓缩、冷却结晶或降温结晶、过滤、洗涤,得到纯净的Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠;先将已知两个热化学方程式编号为①②,观察发现①+②可得③Na2CO3·10H2O(s)==Na2CO3 (s)+10H2O(g) ΔH3=" +532.36" kJ·mol-1,依题意可知④Na2CO3·10H2O(s)==Na2CO3 (s)+10H2O(l) ΔH4=" +92.36" kJ·mol-1,观察发现(④—③)/10可以得到:H2O(g)="=" H2O(l) ΔH=(ΔH4—ΔH3)/10=" —44" kJ·mol-1。
2OH-+H2↑+Cl2↑;阴离子移向阳极,氯离子比氢氧根离子容易失去电子,发生氧化反应,产生黄绿色的气体,即氯气;阳离子移向阴极,氢离子比钠离子容易得到电子,发生还原反应,则阴极产生无色气体,即氢气,由于氢离子被消耗,则阴极附近氢离子浓度减小,所以阴极附近溶液的pH增大;(3)流程III的反应属于复分解反应,即NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl(或者NH3+H2O==NH3?H2O、NH3?H2O+CO2==NH4HCO3、NH4HCO3+NaCl="=" NaHCO3↓+NH4Cl),该反应能够发生的原因是NH4HCO3、NaCl的溶解度均大于NaHCO3,则图中溶解度最小的d表示NaHCO3;(4)由于被提纯物和杂质都是可溶物,杂质可能是NaCl等,根据混合物分离提纯的方法推断,应选择结晶法分离出碳酸钠晶体,因此需要将碳酸钠样品加适量水溶解、蒸发浓缩、冷却结晶或降温结晶、过滤、洗涤,得到纯净的Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠;先将已知两个热化学方程式编号为①②,观察发现①+②可得③Na2CO3·10H2O(s)==Na2CO3 (s)+10H2O(g) ΔH3=" +532.36" kJ·mol-1,依题意可知④Na2CO3·10H2O(s)==Na2CO3 (s)+10H2O(l) ΔH4=" +92.36" kJ·mol-1,观察发现(④—③)/10可以得到:H2O(g)="=" H2O(l) ΔH=(ΔH4—ΔH3)/10=" —44" kJ·mol-1。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 、
、 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。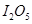 可使
可使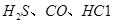 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知: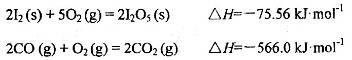
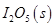 反应生成
反应生成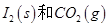 的热化学方程式:________________。
的热化学方程式:________________。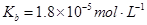

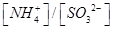 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)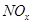 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将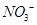 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1

 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。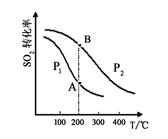
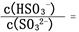 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L) (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
 CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1 HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)