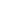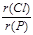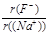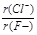题目内容
(11分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
(1)在这些元素中,化学性质最不活泼的元素名称是 ,最高价氧化物对应的水化物是两性氢氧化物的元素是 ,⑤⑥⑩元素中原子半径最大的元素为 。⑧号元素的原子结构示意图为 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,⑧、⑨号元素的氢化物中还原性较强的是 。
(3)②与③形成的化合物属于 (填“共价”或“离子”)化合物。
(4)⑩号元素与水反应的化学方程式为 。
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | | | | | | | |
| 2 | | | | | ② | ③ | | ④ |
| 3 | ⑤ | ⑥ | ⑦ | | | ⑧ | ⑨ | |
| 4 | ⑩ | | | | | | | |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,⑧、⑨号元素的氢化物中还原性较强的是 。
(3)②与③形成的化合物属于 (填“共价”或“离子”)化合物。
(4)⑩号元素与水反应的化学方程式为 。
氖 , Al ,K 各1分 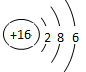 (2分)
(2分)
(2) HClO4、KOH、 H2S(各1分)
(3) 共价 (1分) (4)2K+2H2O==2KOH+H2 ↑ (2分)
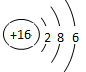 (2分)
(2分) (2) HClO4、KOH、 H2S(各1分)
(3) 共价 (1分) (4)2K+2H2O==2KOH+H2 ↑ (2分)
考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断,①~⑩分别为H、N、O、Ne、Na、Mg、Al、S、Cl、K。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,所以原子半径是K>Na>Mg。非金属性越强,相应氢化物的还原性就越弱,所以硫化氢的还原性大于氯化氢的。N和O都是非金属,形成的化学键是极性键。钾的金属性很强,与水反应剧烈,生成氢氧化钾和氢气。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目