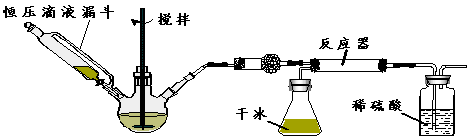
题目内容
海水中含有极为丰富的自然资源。很多常见的金属元素和非金属元素主要以简单离子的形式存在于海水中,海水呈弱碱性。回答下列问题:
海水提溴过程一般分三步,①向浓缩的海水中通入Cl2,将其中的Br-氧化,2Br-+Cl2=Br2+2Cl-,再用热空气吹出溴;②然后用饱和碳酸钠溶液吸收溴,溴歧化为NaBr、NaBrO3,③最后用硫酸酸化5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
(1)写出第②步反应的离子方程式 ;
(2)海水浓缩后还要进一步处理才能通入Cl2,处理的方法是 ,目的是 ,步骤③用硫酸而不用盐酸酸化的原因可能是 ;
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中 ;
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)海水制溴的原理体现了化学工业中“富集”“放大”思想。以海水为原料制备金属镁分三步,试写出其反应原理(用化学方程式表示)
, , 。
海水提溴过程一般分三步,①向浓缩的海水中通入Cl2,将其中的Br-氧化,2Br-+Cl2=Br2+2Cl-,再用热空气吹出溴;②然后用饱和碳酸钠溶液吸收溴,溴歧化为NaBr、NaBrO3,③最后用硫酸酸化5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
(1)写出第②步反应的离子方程式 ;
(2)海水浓缩后还要进一步处理才能通入Cl2,处理的方法是 ,目的是 ,步骤③用硫酸而不用盐酸酸化的原因可能是 ;
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中 ;
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)海水制溴的原理体现了化学工业中“富集”“放大”思想。以海水为原料制备金属镁分三步,试写出其反应原理(用化学方程式表示)
, , 。
(1)Br2+3CO32-=5Br-+BrO3-+3CO2(2分)
(2)酸化 海水显碱性防止Cl2歧化 NaBrO3有强氧化性易将HCl氧化生成Cl2 (每空1分)
(3)ac (2分)
(4)MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2 Mg+Cl2↑(每空1分)(多写CaO与H2O反应方程式不扣分)
Mg+Cl2↑(每空1分)(多写CaO与H2O反应方程式不扣分)
(2)酸化 海水显碱性防止Cl2歧化 NaBrO3有强氧化性易将HCl氧化生成Cl2 (每空1分)
(3)ac (2分)
(4)MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2
 Mg+Cl2↑(每空1分)(多写CaO与H2O反应方程式不扣分)
Mg+Cl2↑(每空1分)(多写CaO与H2O反应方程式不扣分)试题分析:(1)卤素单质在碱性环境容易发生歧化反应。根据题意结合电荷守恒和质量守恒定律,可得方程式为:Br2+3CO32-=5Br-+BrO3-+3CO2。(2)海水浓缩后通入Cl2前还要进行酸化处理,否则氯气会发生歧化反应。③用硫酸酸化而不用盐酸酸化是因为NaBrO3有强氧化防止它把易将HCl氧化生成Cl2。(3)除去杂质的原则是“不增”“不减”。即不增加新的杂质,不减少被提存的物质的量。根据它们的活动性关系为了除去工业Br2中微量的Cl2,可向工业Br2中通入HBr或加入NaBr溶液即选ac。(4)海水中镁元素是以氯化镁的形式存在。所以首先加入价廉的熟石灰将其转化为氢氧化镁沉淀。将沉淀过滤、洗涤后用盐酸溶解得到纯净的氯化镁溶液。然后在氯化氢的环境中加热氯化镁溶液得到无水氯化镁。最后将其电解即可得到金属镁。反应原理用方程式表示为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2
 Mg+Cl2↑
Mg+Cl2↑
练习册系列答案
相关题目
 ⑵
⑵ ⑶
⑶ ⑷
⑷
 NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。