题目内容
12.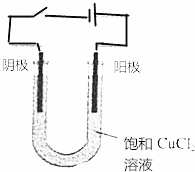 按图所示装置连接好仪器,在U形管中加入氯化化铜溶液,用石墨棒作电极,接通电源,电解数分钟后观察阴极(与电源负极连接的石墨棒)表面的颜色,用湿润的淀粉碘化钾试纸检验阳极(与电源正极相连接的石墨棒)上放出的气体.
按图所示装置连接好仪器,在U形管中加入氯化化铜溶液,用石墨棒作电极,接通电源,电解数分钟后观察阴极(与电源负极连接的石墨棒)表面的颜色,用湿润的淀粉碘化钾试纸检验阳极(与电源正极相连接的石墨棒)上放出的气体.(1)阴极的现象为有红色物质析出发生的电极反应为Cu2++2e-=Cu
(2)阳极的现象为阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色发生的电极反应为2Cl--2e-=Cl2↑
(3)电解反应的化学方程式为CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑
(4)在上述电解反应中,被氧化的物质是CuCl2被还原的物质是CuCl2
(5)在化学反应中发生的能量转化形式是电能转化为化学能.
分析 用惰性电极电解CuCl2溶液时,
(1)阴极上Cu2+放电生成Cu,电极反应式为Cu2++2e-=Cu;
(2)阳极上Cl-放电生成Cl2,电极反应式为2Cl--2e-=Cl2↑;
(3)阴极上Cu2+放电、阳极上Cl-放电,所以实质上是电解氯化铜生成氯气和Cu;
(4)电解反应中,失电子化合价升高的物质被氧化,得电子化合价降低的物质被还原;
(5)该装置是电解池,是将电能转化为化学能的装置.
解答 解:用惰性电极电解CuCl2溶液时,
(1)阴极上Cu2+放电生成Cu,电极反应式为Cu2++2e-=Cu,所以看到的现象是:阴极上有红色物质析出,故答案为:有红色物质析出;Cu2++2e-=Cu;
(2)阳极上Cl-放电生成Cl2,电极反应式为2Cl--2e-=Cl2↑,氯气具有强氧化性,能氧化碘离子生成碘,碘遇淀粉试液变蓝色,所以看到的现象是:阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色,
故答案为:阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色;2Cl--2e-=Cl2↑;
(3)阴极上Cu2+放电、阳极上Cl-放电,所以实质上是电解氯化铜生成氯气和Cu,电解反应式为CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,故答案为:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑;
(4)电解反应中,失电子化合价升高的物质被氧化,得电子化合价降低的物质被还原,根据CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑知,被氧化的物质和被还原的物质都是CuCl2,
故答案为:CuCl2;CuCl2;
(5)该装置是电解池,是将电能转化为化学能的装置,所以该反应中能量转化方式为:电能转化为化学能,故答案为:电能转化为化学能.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应及氯气检验方法是解本题关键,难点是电极反应式的书写,题目难度不大.

| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为 H2(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;\;120℃\;\;\;}}{101KPa}$H2O(g)△H=-242 kJ/mol | |
| D. | 25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ/mol |
| A. | 该物质属于氢氧化物 | |
| B. | 该物质的摩尔质量是160g•mol-1 | |
| C. | 该物质的碱性不强 | |
| D. | 将1molNaAl(OH)2CO3溶于足量1mol•L-1HCl中时,共收集到2.5molCO2 |
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
| A. | CO2 是氧化产物 | |
| B. | 1mol KClO3 参加反应,转移的电子为1mol | |
| C. | KClO3 在反应中被氧化 | |
| D. | H2C2O4的还原性强于ClO2 的还原性 |
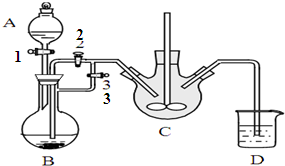 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: