题目内容
20.高效水处理剂ClO2在实验室中通过以下反应制得:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )| A. | CO2 是氧化产物 | |
| B. | 1mol KClO3 参加反应,转移的电子为1mol | |
| C. | KClO3 在反应中被氧化 | |
| D. | H2C2O4的还原性强于ClO2 的还原性 |
分析 2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O(O均为-2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,以此来解答.
解答 解:A.该反应中C元素的化合价由+3价升高到+4价,所以草酸是还原剂,失去电子被氧化,则CO2是氧化产物,故A正确;
B.由Cl元素化合价变化可知,1mol KClO3 参加反应,转移的电子为1mol×95-4)=1mol,故B正确;
C.Cl元素的化合价降低,则KClO3为氧化剂,被还原,故C错误;
D.该反应中草酸是还原剂,二氧化氯是还原产物,所以草酸的还原性大于ClO2的还原性,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从化合价的变化角度分析氧化还原反应问题,题目难度不大.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
11.在一定条件下,当64g SO2气体被氧化成SO3气体时,共放出热量98.3kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是( )
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(l)△H=-196.6 kJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-78.64 kJ•mol-1 | |
| D. | 2SO2(g)+O2(g)?2SO3(g)△H=+196.6 kJ•mol-1 |
5.对于下列反应的反应类型的判断,不正确的是( )
| A. | CO2+H2O═H2CO3 化合反应 | |
| B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O 分解反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3 复分解反应 |
12.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的 Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2 溶于水,可将含有 Ba(NO3)2 的废液倒入水池中,再用水冲入下水道 | |
| C. | 用蒸发方法使 NaCl 从溶液中析出时,应将蒸发皿中 NaCl 溶液全部蒸干才停止加热 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
9.盆栽鲜花一般需施用S-诱抗素制剂,以保证鲜花长期盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )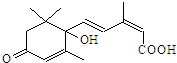

| A. | 该物质的分子式为C15H20O4 | |
| B. | 能发生消去反应 | |
| C. | 既能与FeCl3溶液发生显色反应,又能使溴水褪色 | |
| D. | 1mol该物质与NaOH溶液反应,最多可消耗1mol NaOH溶液 |
10.下列物质按电解质、非电解质、混合物排序正确的是( )
| A. | 盐酸、硫酸、五水硫酸铜 | B. | NH3、Cu、空气 | ||
| C. | NaOH、SO2、空气 | D. | 氨水、食盐、酒精 |
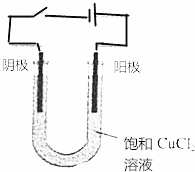 按图所示装置连接好仪器,在U形管中加入氯化化铜溶液,用石墨棒作电极,接通电源,电解数分钟后观察阴极(与电源负极连接的石墨棒)表面的颜色,用湿润的淀粉碘化钾试纸检验阳极(与电源正极相连接的石墨棒)上放出的气体.
按图所示装置连接好仪器,在U形管中加入氯化化铜溶液,用石墨棒作电极,接通电源,电解数分钟后观察阴极(与电源负极连接的石墨棒)表面的颜色,用湿润的淀粉碘化钾试纸检验阳极(与电源正极相连接的石墨棒)上放出的气体.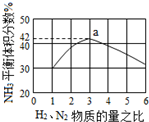 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.