题目内容
20.铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响.请完成下列各题:(1)在化学反应中,铜元素可表现为0、+1、+2价.
①铜器表面有时会生成铜绿Cu(OH)2CO3,这层铜绿可用化学方法除去.试写出除去铜绿而不损伤器物的反应的化学方程式:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑或Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
②新制的铜试剂Cu(OH)2与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量.葡萄糖的结构简式如下:CH2OH(CHOH)4CHO(简写为GCHO)
试写出GCHO与Cu(OH)2反应的化学方程式:GCHO+2Cu(OH)2$\stackrel{△}{→}$GCOOH+Cu2O↓+2H2O
(2)铜钱在历史上曾经是一种广泛流通的货币,试从物理性质和化学性质的角度分析为什么铜常用于制造货币.(与铁比较,铜的熔点1183.4℃,铁的熔点1534.8℃).铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型.
分析 (1)①除去铜绿而不损伤器物可以和盐酸或稀硫酸反应而除去,铜不与盐酸和硫酸反应,铜绿可以和盐酸或稀硫酸反应,生成可溶于水的铜盐和二氧化碳气体、水;
②葡萄糖和新制的铜试剂在加热下反应生成氧化亚铜沉淀、葡萄糖酸和水;
(2)结合题目中所给出的信息,根据铜与铁相比具有的优点解答.
解答 解:(1)①可以和盐酸或稀硫酸反应而除去,生成可溶于水的铜盐和二氧化碳气体、水.Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑或Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
故答案为:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑或Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
②葡萄糖和新制的铜试剂在加热下反应生成氧化亚铜沉淀、葡萄糖酸和水,即GCHO+2Cu(OH)2$\stackrel{△}{→}$GCOOH+Cu2O↓+2H2O,
故答案为:GCHO+2Cu(OH)2$\stackrel{△}{→}$GCOOH+Cu2O↓+2H2O;
(2)铜的熔点是1183.4℃、铁的熔点是1534.8℃,说明铜的熔点比铁的熔点低,便于铸造;货币流通的次数比较多,所以要防止生锈,铁比铜易锈蚀,
故答案为:铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型.
点评 本题考查金属铁、铜的性质以及化学方程式的书写知识,掌握铁腐蚀的原理为解答的关键,题目难度中等.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | pH=3的盐酸和pH=11的氨水等体积混合pH=7 | |
| B. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合pH<7 | |
| C. | pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合pH>7 | |
| D. | 取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为0.005mol•L-1 |
11.某温度下,H2(g)+CO2 (g)?H2O(g)+CO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2 (g)和CO2 (g),其起始浓度如表所示,下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,乙中CO2的转化率大于60% | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol•L-1 | |
| D. | 反应开始时,乙中的反应速率最快,甲中的反应速率最慢 |
8.一定条件下下列变化不可能通过一步反应实现的是( )
| A. | Na2CO3→Na2SiO3 | B. | Si→SiO2 | C. | SiO2→H2SiO3 | D. | CuSO4→CuCl2 |
15.等物质的量的①Na②Na2O③Na2O2④NaOH,分别与足量水作用后并稀释成相同体积,所得溶液物质的量浓度的说法正确的是,( )
| A. | ①②③④都不相等 | B. | ①④和②③分别相等 | C. | ②③相等,①④不等 | D. | ①④相等,②③不等 |
9.下列说法正确的是( )
| A. | 用pH试纸测氯水的pH | |
| B. | 保存液溴时液面覆盖一层水,并装在带玻璃塞的试剂瓶中 | |
| C. | 用稀盐酸清洗做过银镜反应的试管内壁 | |
| D. | 除去NaBr溶液中的NaI,可先加氯水,再用CCl4萃取分液 |
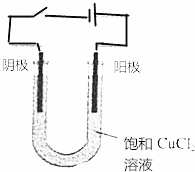 按图所示装置连接好仪器,在U形管中加入氯化化铜溶液,用石墨棒作电极,接通电源,电解数分钟后观察阴极(与电源负极连接的石墨棒)表面的颜色,用湿润的淀粉碘化钾试纸检验阳极(与电源正极相连接的石墨棒)上放出的气体.
按图所示装置连接好仪器,在U形管中加入氯化化铜溶液,用石墨棒作电极,接通电源,电解数分钟后观察阴极(与电源负极连接的石墨棒)表面的颜色,用湿润的淀粉碘化钾试纸检验阳极(与电源正极相连接的石墨棒)上放出的气体.