题目内容
【题目】碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如图所示. 
请回答下列问题:
(1)判断反应①中碘是否反应完全的方法是 .
(2)操作Ⅰ的名称是 .
(3)反应①的化学方程式为
(4)反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3 , 写出该反应的化学方程式并用双线桥法表示此反应的电子转移的方向及数目 .
(5)在反应②中若有99g NaIO3被还原,则转移电子的物质的量为mol.
【答案】
(1)取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全(或取少量反应后的溶液于试管中,滴入几滴CCl4 , 振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全)
(2)过滤
(3)3I2+6NaOH═5NaI+NaIO3+3H2O
(4)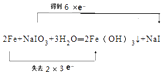
(5)3
【解析】解:(1)淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应①中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4 , 振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全),所以答案是:取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全(或取少量反应后的溶液于试管中,滴入几滴CCl4 , 振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全);(2)由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3 , 加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,操作I为过滤,
所以答案是:过滤;(3)反应①为碘单质和氢氧化钠的反应,化合价升高和降低的元素均是I元素,化合价升高的I元素对应的产物NaIO3 , 化合价降低的I元素对应的产物为NaI,根据得失电子守恒,氧化剂和还原剂的物质的量之比是5:1,所以在反应的3molI2中,有 ![]() mol的I2做还原剂,有
mol的I2做还原剂,有 ![]() mol的I2做氧化剂,反应的方程式为:3I2+6NaOH═5NaI+NaIO3+3H2O,
mol的I2做氧化剂,反应的方程式为:3I2+6NaOH═5NaI+NaIO3+3H2O,
所以答案是:3I2+6NaOH═5NaI+NaIO3+3H2O;(4)反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3 , 该反应中,NaIO3中碘元素的化合价由+5价变为﹣1价,所以NaIO3是氧化剂,Fe单质中Fe元素化合价由0价升高到+3价,被氧化,根据得电子与失电子个数相等,两者的物质的量之比是1:2,则电子转移的方向和数目为: 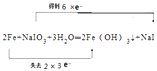 ,所以答案是:
,所以答案是:  ;(5)反应②的化学方程式是2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI,NaIO3中碘元素的化合价由+5价变为﹣1价,若有99g NaIO3被还原,转移电子为
;(5)反应②的化学方程式是2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI,NaIO3中碘元素的化合价由+5价变为﹣1价,若有99g NaIO3被还原,转移电子为 ![]() ×[(+5)﹣(﹣1)]=3mol,
×[(+5)﹣(﹣1)]=3mol,
所以答案是:3.