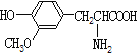题目内容
【题目】氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为
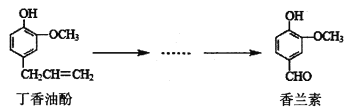
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
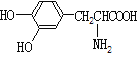
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A.H2B.COC.C8H18D.CH4
【答案】B
【解析】
由热化学方程式氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+![]() O2(g)═H2O(l)△H=-285.8kJ/mol可知,1mol氢气燃烧放出的热量为285.8kJ,1mol氢气的质量为1mol×2g/mol=2g,故1g氢气燃烧放出的热量为:285.8kJ×
O2(g)═H2O(l)△H=-285.8kJ/mol可知,1mol氢气燃烧放出的热量为285.8kJ,1mol氢气的质量为1mol×2g/mol=2g,故1g氢气燃烧放出的热量为:285.8kJ×![]() =142.9kJ;
=142.9kJ;
由热化学方程式CO(g)+![]() O2(g)═CO2(g)△H=-283.0kJ/mol,可知,1molCO燃烧放出的热量为283kJ,1molCO的质量为1mol×28g/mol=28g,故1gCO燃烧放出的热量为:283kJ×
O2(g)═CO2(g)△H=-283.0kJ/mol,可知,1molCO燃烧放出的热量为283kJ,1molCO的质量为1mol×28g/mol=28g,故1gCO燃烧放出的热量为:283kJ×![]() =10.1kJ;
=10.1kJ;
由热化学方程式C8H18(l)+![]() O2(g)═8CO2(g)+9H2O(l)△H=-5518kJ/mol可知,1molC8H18燃烧放出的热量为5518kJ,1molC8H18的质量为1mol×114g/mol=114g,故1gC8H18燃烧放出的热量为:5818kJ×
O2(g)═8CO2(g)+9H2O(l)△H=-5518kJ/mol可知,1molC8H18燃烧放出的热量为5518kJ,1molC8H18的质量为1mol×114g/mol=114g,故1gC8H18燃烧放出的热量为:5818kJ×![]() =51kJ;
=51kJ;
由热化学方程式CH4 (g)+2O2(g)═CO2(g)+2H2O (l)△H=-890.3KJ/mol 可知,1molCH4燃烧放出的热量为890.3kJ,1molCH4的质量为1mol×16g/mol=16g,故1gCH4燃烧放出的热量为:890.3kJ×![]() =55.6kJ;
=55.6kJ;
则CO放出的热量最少,故答案为B。