题目内容
【题目】电解法处理酸性含铬废水(主要含有![]() )时,以铁板作阴、阳极,处理过程中存在反应
)时,以铁板作阴、阳极,处理过程中存在反应![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是 ( )
+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是 ( )
A.阳极反应为Fe-2e-=Fe2+
B.电解过程中溶液c(H+)不会变化
C.处理过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol![]() 被还原
被还原
【答案】B
【解析】
A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应为Fe-2e-═Fe2+,故A正确;
B.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子,溶液中c(H+)减小,故B错误;
C.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,有Fe(OH)3沉淀生成,故C正确;
D.Fe-2e-=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e-~6Fe2+~Cr2O72-,故被还原的Cr2O72-的物质的量为1mol,故D正确;
故答案为B。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为____。
(2)尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为____。
(3)在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
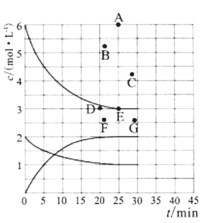
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(4)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:![]()
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____。
②已知该反应![]() ,其中k1、k2为速率常数,则373K时,
,其中k1、k2为速率常数,则373K时,![]() =_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
=_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。