题目内容
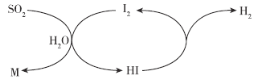
【题目】CH3OH是一种重要的化工原料。工业上常以CO和H2的混合气体为原料制备甲醇,其反应方程式为CO+2H2CH3OH。
(1)一定条件下向2 L的密闭容器中通入一定量的CO和H2使其发生上述反应,n(CO)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 1.0 | 0.8 | 0.5 | 0.25 | 0.20 | 0.20 |
①平均反应速率最大的时间段:___________min(填 “0~1”、“1~2” 、“2~3”“3~4”或“4~5”)。
②从反应开始到3 min末,氢气的平均反应速率v(H2)=______________mol·L-1·min-1
③能够判断该反应达到平衡的是________(填字母) 。
a.v逆(CO)=2v正(H2)
b.CO、H2和CH3OH三种物质的浓度相等
c.CH3OH分解的速率和CH3OH生成的速率相等
d.相同时间内消耗1molCO,同时消耗1molCH3OH
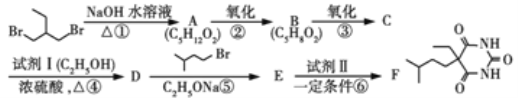
④工业上用CO和H2为原料制备甲醇的过程中,会有副产物二甲醚(CH3OCH3)生成,写出该反应的化学方程式:__________.
(2)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气、KOH溶液构成,电池总反应为2CH3OH+3O2+4OH-=2![]() + 6H2O,其装置图下图所示。
+ 6H2O,其装置图下图所示。
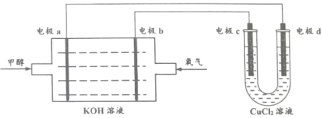
①电极a为电池的_______(填 “正极”或“负极”)
②电极b的电极反应式:________。
③电极C的电极反应式:________。
【答案】1~2 0.25 cd 2CO+4H2→CH3OCH3+H2O 负极 O2+4e-+2H2O=4OH- 2Cl--2e-=Cl2
【解析】
(1)①由不同时间段CO物质的量的变化量多少进行判断;
②先计算出CO的平均反应速率,再根据速率之比等于化学计量数之比计算出H2的平均反应速率;
③可逆反应达到平衡状态的判断标志是原来变化的量不变了,据此分析判断;
④由甲醇与二甲醚的分子式之间的关系进行分析;
(2)甲醇燃料电池中,甲醇在负极发生氧化反应,氧气在正极发生还原反应,据此分析解答。
(1)①在5min内的几个时间段内,CO物质的量的减少量分别为:0.2mol、0.3mol、0.25mol、0.05mol、0mol,从而可以确定平均反应速率最大的时间段为CO物质的量的减少量最多的时间段,即1~2min,答案为:1~2;
②由表中数据可知,从反应开始到3 min末,CO物质的量的减少量为1.0mol-0.25mol=0.75mol,则v(CO)= =0.125 mol·L-1·min-1,根据速率之比等于化学计量数之比,反应CO+2H2CH3OH中氢气的平均反应速率v(H2)=2v(CO)=2×0.125 mol·L-1·min-1=0.25 mol·L-1·min-1,答案为:0.25;
=0.125 mol·L-1·min-1,根据速率之比等于化学计量数之比,反应CO+2H2CH3OH中氢气的平均反应速率v(H2)=2v(CO)=2×0.125 mol·L-1·min-1=0.25 mol·L-1·min-1,答案为:0.25;
③反应为CO+2H2CH3OH
a. 根据反应可得出v正(H2)=2 v正(CO),故v逆(CO)=2v正(H2)时反应没有达到平衡,a不符题意;
b. CO、H2和CH3OH三种物质的浓度相等,反应可能处于平衡状态,也可能未处于平衡状态,这与反应开始时加入的反应物的多少及反应的转化率等有关,b不符题意;
c.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,即正逆反应速率相等,可以判断反应达到平衡,c符合题意;
d. 对于反应CO+2H2CH3OH,相同时间内消耗1molCO,同时消耗1molCH3OH说明正逆反应速率相等,可以判断反应达到平衡,d符合题意,答案选cd;
④1mol的二甲醚(CH3OCH3)可以看作是2mol的甲醇(CH3OH)发生分子间脱水生成,由CO+2H2CH3OH可以推出用CO和H2生成副产物二甲醚的反应为:2CO+4H2→CH3OCH3+H2O,答案为:2CO+4H2→CH3OCH3+H2O;
(2)甲醇燃料电池甲醇在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应
①由图可知电极a处通入甲醇,故电极a为负极,答案为:负极;
②由图可知电极b处通入氧气,电极b为正极,氧气在正极得到电子发生还原反应,碱性条件下氧气发生的反应为:O2+4e-+2H2O=4OH-,答案为:O2+4e-+2H2O=4OH-;
③由图可知电极c与燃料电池的正极相连,所以电极c为电解池的阳极,电极c为惰性电极,电解质溶液为CuCl2溶液,所以在电极c上发生反应的是溶液里的阴离子,由于放电顺序Cl->OH-,故电极c的电极反应式为:2Cl--2e-=Cl2,答案为:2Cl--2e-=Cl2。