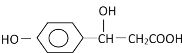
题目内容
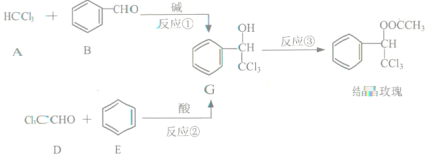
【题目】我国科学家受中医启发,发现As2O3(俗称砒霜)对白血病有疗效。氮、磷、砷(As)是VA族、第二至第四周期的元素,这些元素的化合物在研究和生产中有许多重要用途。
完成下列填空:
(1)As原子最外层电子的轨道表示式为_____________;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是__________。
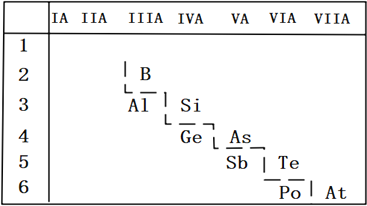
(2)P的非金属性比As强,从原子结构的角度解释其原因_______;如图是元素周期表的一部分,请推测砷的单质或其化合物可能具有的性质_______________(写出两条即可)
(3)NH4NO3可做化肥,但易爆,300℃发生爆炸:2NH4NO3→2N2↑+O2↑+4H2O。每生成2molN2,反应中转移的电子为_____mol,氧化产物与还原产物的质量之比为_____。
(4)发电厂常用氨气吸收烟气中的CO2。常温下,当CO2不断通入pH=11的氨水中时会产生微量的新离子:NH2COO-。
(i)写出NH2COO-的电子式___________。
(ii)计算原氨水中c(NH4+)=_______mol/L。
【答案】![]() 60o P原子核外有三个电子层,As原子核外有四个电子层,P的原子半径<As,P吸引电子的能力更强,所以P的非金属性更强 砷是半导体,砷的氧化物是两性氧化物、砷的最高价氧化物对应水化物是两性氢氧化物等 10 15:7
60o P原子核外有三个电子层,As原子核外有四个电子层,P的原子半径<As,P吸引电子的能力更强,所以P的非金属性更强 砷是半导体,砷的氧化物是两性氧化物、砷的最高价氧化物对应水化物是两性氢氧化物等 10 15:7 ![]() 10-3-10-11(或10-3)
10-3-10-11(或10-3)
【解析】
(1)As的最外层有5个电子,As原子最外层电子的轨道表示式为![]() ;As4分子结构与白磷(P4)相似,也是正四面体,键角为60o;
;As4分子结构与白磷(P4)相似,也是正四面体,键角为60o;
(2)由于为P原子核外有三个电子层,As原子核外有四个电子层,P的原子半径小于As,P吸引电子的能力更强,所以P的非金属性更强;由位置可知,砷是半导体,则砷的氧化物是两性氧化物、砷的最高价氧化物对应水化物是两性氢氧化物;
(3)该反应2NH4NO3→2N2↑+O2↑+4H2O中N元素化合价由3价、+5价变为0价,O元素的化合价由2价升高为0,则氮气既是氧化产物也是还原产物,氧气为氧化产物,转移电子个数为10,则每生成2molN2,反应中转移的电子为10mol,氧化产物与还原产物的质量之比为(32+28):28=15:7。
(4)①NH2COO的电子式为![]() ;
;
②pH=11的氨水中,c(H+)=10-11mol/L,c(OH-)=10-3mol/L,由电荷守恒可知,c(NH4+)+c(H+)= c(OH-),解得c(NH4+)=(10-3-10-11) mol/L或=10-3mol/L。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___。
【题目】叙述和叙述Ⅱ都正确并有因果关系的是
选项 | 叙述 | 叙述Ⅱ |
A | 氢氟酸是强酸 | 氢氟酸能刻蚀玻璃 |
B | 氨易液化 | 液氨常用作致冷剂 |
C | 碳酸钠常做面包的发泡剂 | 碳酸钠受热易分解 |
D | KNO3的溶解度大 | 用重结晶法除去KNO3中含有的NaCl |
A.AB.BC.CD.D