��Ŀ����
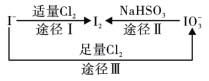
����Ŀ���Ȼ���ͭ(CuCl)��һ��Ӧ�ýϹ�Ĵ������й����ʵ�ת����ϵ����ͼ��ʾ����B��E�⣬��Ϊ��Ӧ���ʵ���Һ�μӷ�Ӧ������������ͷ�Ӧ��������ȥ��������BΪ���壬��ʹƷ����Һ��ɫ��CΪ���Σ�DΪ��Ҫ�ĵ�ζ����EΪһ�ֺ�ɫ�Ľ��������M��Ħ������Ϊ34gmol-1������ˮ��Һ����ҽ������Һ��

��1��E�Ļ�ѧʽ________________________��
��2��N�ĵ���ʽΪ________________________��
��3��д����Ӧ�ٵĻ�ѧ����ʽ��_________________________________________��
��4��д����Ӧ�ڵ����ӷ���ʽ��_________________________________________��
���𰸡�Cu2O ![]() SO2+H2O2=H2SO4 2Cu2++SO32-+2Cl-+H2O
SO2+H2O2=H2SO4 2Cu2++SO32-+2Cl-+H2O![]() 2CuCl��+SO42-+2H+
2CuCl��+SO42-+2H+
��������
�������ʵ��������ʽ��������������ƶϷ�Ӧ���̣�����������ԭ��Ӧ�ĸ��������ƽ��д��ѧ�����ӷ�Ӧ����ʽ��
������ʾ��֪������BΪ���壬��ʹƷ����Һ��ɫ����B��SO2�� DΪ��Ҫ�ĵ�ζ������D��NaCl�����NaClˮ��Һ�õ�NaOH����N��NaOH��NaOH��SO2��Ӧ���ɵ�������Na2SO3����C��Na2SO3��EΪһ�ֺ�ɫ�Ľ����������E��Cu2O��M��Ħ������Ϊ34gmol-1������ˮ��Һ����ҽ������Һ����M��H2O2����Ӧ�ټ�Ϊ˫��ˮ���������Ӧ�������ᣬ����ʽΪ��SO2+H2O2=H2SO4��������Cu2O�ڼ��ȵ������·�Ӧ��������ͭ�����������ˮ����Ӧ��������ͭ���Ȼ��ơ��������Ʒ�Ӧ�����Ȼ���ͭ�����ӷ���ʽΪ��2Cu2++SO32-+2Cl-+H2O![]() 2CuCl��+SO42-+2H+��
2CuCl��+SO42-+2H+��
�ʴ�Ϊ��Cu2O��![]() ��SO2+H2O2=H2SO4��2Cu2++SO32-+2Cl-+H2O
��SO2+H2O2=H2SO4��2Cu2++SO32-+2Cl-+H2O![]() 2CuCl��+SO42-+2H+��
2CuCl��+SO42-+2H+��

����Ŀ��I���ڻ���ƽ�����װ��ǿ��ԭ���£�N2H4����ǿ��������H2O2���������ǻ��ʱ������������![]() N2��ˮ���������ų������ȣ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ�������ų�256kJ��������
N2��ˮ���������ų������ȣ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ�������ų�256kJ��������
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ_______________________________________��
��2����֪H2O��l���TH2O��g������H=+44kJ��mol��1����16gҺ̬��ȼ�����ɵ�����Һ̬ˮʱ���ų���������________kJ��
��3������ȼ�տ���ͨ����������;����
;��I��C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H=��a kJ��mol��1
;��II��C3H8��g���TC3H6��g��+H2��g����H=+b kJ��mol��1
2C3H6��g��+9O2��g���T6CO2��g��+6H2O��l����H=��c kJ��mol��1
2H2��g��+O2 ��g���T2H2O��l����H=��d kJ��mol��1 ��abcd��Ϊ��ֵ��
��ش��������⣺
���жϵ����ı���ͨ������;���ų���������;��I�ų�������_______��������������������������С������;��II�ų���������
����C3H8��g���TC3H6��g��+H2��g�� �ķ�Ӧ�У���Ӧ����е�������________��������������������������С��������������е���������
��b ��a��c��d����ѧ��ϵʽ��_____________��
II��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�

������Ͳ��ȡ50 mL 0.50 mol��L1���ᵹ��С�ձ��У���������¶ȣ�������һ��Ͳ��ȡ50 mL 0.55 mol��L1 NaOH��Һ������ͬһ�¶ȼƲ�����¶ȣ��۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȡ�
�ش��������⣺
��1��Ϊʲô����NaOH��ҺҪ�Թ�����__________________________��
��2���������������������Һ���ܶȶ���1 g��cm3����֪�кͷ�Ӧ��������Һ�ı�����c��4.18 J��g1����1��Ϊ�˼����к��ȣ�ijѧ��ʵ���¼�������£�
ʵ�� ��� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | �������� | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к�����H��________kJ��mol1_(�������һλС��)��
��3��������Ba(OH)2��Һ�������������������Һ�����ᣬ������_________________��