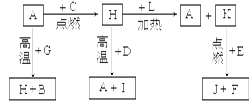题目内容
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
| A.22.1 g | B.27.2 g | C.30 g | D.无法计算 |
B
解析试题分析:合金先和硝酸反应,失去电子变为离子,然后三种金属离子又和NaOH反应全部变为沉淀,所以总的来看,沉淀的质量就是金属的质量加上所得的OH—的质量,而金属所得的OH—的物质的量与失去的电子的物质的量相等。金属失去的电子全部转移给了N得到NO,故n(OH—)=n(e—)=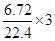 mol=0.9mol,所得沉淀的质量为11.9+17×0.9=27.2g。
mol=0.9mol,所得沉淀的质量为11.9+17×0.9=27.2g。
考点:考查化学计算技巧和方法,氧化还原反应规律。

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24 L水中所含电子总数为NA |
| B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42-数为0.2NA |
| C.苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
| D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA |
NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.22.4L NH3中含氮原子数为NA |
| B.1 mol Na2O2与水完全反应时转移的电子数为NA |
| C.1 L 0.1mol·L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| D.1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.常温常压下,18gH218O含有的原子总数为3NA |
| B.标准状况下,4.2gCH2=CH2和CH3CH=CH2的混合气体中所含有的碳原子数为0.3NA |
| C.将0.1molCl2通入1L水中,转移的电子数目为0.1NA |
| D.0.1mol·L-1Al2(SO4)3溶液中含有的Al3+总数为0.2NA |
下列电子式书写正确的是
A.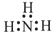 | B. | C.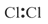 | D. |
用1molMnO2和含HCl为4mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气的物质的量
| A.等于2mol | B.等于1mol | C.小于1 mol | D.大于2 mol |
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A.足量Fe与1 mol Cl2燃烧反应时,转移的电子数为3 NA |
| B.1 mol NO2与足量H2O反应,转移的电子数为NA |
| C.常温常压下,9.2g的NO2和N2O4混合气体中含有的氮原子数为0.2 NA |
| D.高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数为0.4 NA |
有关碳元素及其化合物的化学用语正确的是
A.CO2的电子式: |
B.乙烯的比例模型: |
| C.醋酸钠的分子式:C2H3O2Na |
D.C原子最外层电子的轨道表示式: |