题目内容
NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.22.4L NH3中含氮原子数为NA |
| B.1 mol Na2O2与水完全反应时转移的电子数为NA |
| C.1 L 0.1mol·L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| D.1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
B
解析试题分析:气体摩尔体积与温度、压强有关,缺少“标准状况下”条件,不能根据V÷22.4L/mol求氨气的物质的量,因此不能求氨气中所含氮原子的物质的量及数目,故A错误;过氧化钠与水反应时既是氧化剂又是还原剂,氧元素化合价升降总数都是1,则2Na2O2+2H2O=4NaOH+O2↑~2eˉ,由于系数之比等于物质的量之比,则1mol 过氧化钠与水完全反应转移1mol电子,故B正确;由于n=c?V,则溶液中Na2CO3为0.1mol,碳酸钠完全电离出0.1mol碳酸根离子,碳酸根离子部分水解:CO32-+H2O HCO3-+OH-,导致阴离子的物质的量增多,因此该溶液所含阴离子的物质的量大于0.1mol,故C错误;氧气与二氧化硫的反应是可逆反应:2SO2+O2
HCO3-+OH-,导致阴离子的物质的量增多,因此该溶液所含阴离子的物质的量大于0.1mol,故C错误;氧气与二氧化硫的反应是可逆反应:2SO2+O2 2SO3,正反应不能进行到底,反应后不可能只有2mol三氧化硫,同时存在二氧化硫、氧气、三氧化硫,反应后混合气体总的物质的量介于2mol和3mol之间,故D错误。
2SO3,正反应不能进行到底,反应后不可能只有2mol三氧化硫,同时存在二氧化硫、氧气、三氧化硫,反应后混合气体总的物质的量介于2mol和3mol之间,故D错误。
考点:考查阿伏加德罗常数,涉及气体摩尔体积、物质的组成、特殊氧化还原反应中转移电子数、体积、物质的量浓度、盐类水解、物质的量、可逆反应等。

 名校课堂系列答案
名校课堂系列答案室温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是(设NA表示阿伏加德罗常数的值)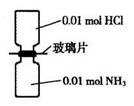
| A.气体反应物的总体积为0.448L |
| B.装置中氢元素的总质量为0.04g |
| C.生成物中含有0.01NA个分子 |
| D.生成物完全溶于永后所得溶液含有0.01 NA个NH4+ |
设NA为阿伏加德罗常数的数值,则下列叙述正确的是
| A.1 mol氨基(—NH2)中含电子数为10NA |
| B.标准状况下,2.24 L18O2中所含中子的数目是2NA |
| C.标准状况下,22.4 L C8H18中含有的共价键键数为25NA |
| D.在反应CaO + 3C = CaC2 + CO↑中,每生成1 mol CO,转移的电子数为3NA |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,18gH2O中含有2nA个氢原子 |
| B.标准状况下,22.4L苯含有nA个苯分子 |
| C.1mol Na与足量水反应转移2nA个电子 |
| D.0.1 mol?L-1CH3COOH溶液中含有0.1nA个CH3COO- |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.常温常压下,4.4g CO2和4.4g N2O的原子总数都是0.3NA |
| B.次氯酸光照分解产生22.4mL气体(标准状况下),转移电子数为0.002NA |
| C.常温下,4.6g乙醇含有C—H键总数为0.6 NA |
| D.0.2 mol·L-1 FeCl3溶液中含有Cl-总数为0.6NA |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
| B.1mol Na2CO3晶体中含CO2- 3离子数小于1 NA |
| C.惰性电极电解食盐水,若线路中通过1 NA电子,则阳极产生气体11.2L |
| D.0.1 mol的CaO2中含阴离子数是0.2 NA |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B.常温常压下,22 g14CO2中所含分子数为0.5 NA |
| C.室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D.7.8g Na2O2与足量水反应,转移电子数为0.2NA |
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
| A.22.1 g | B.27.2 g | C.30 g | D.无法计算 |
下列各项表达中,正确的是
A.水的电子式为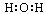 |
| B.将58g等体积的乙烯和乙烷混合物完全燃烧,生成的二氧化碳体积为89.6L |
| C.所有的氮原子中,质子数都是7个,但不一定是相同的原子 |
D.氯离子的结构示意图为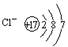 |