题目内容
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A.足量Fe与1 mol Cl2燃烧反应时,转移的电子数为3 NA |
| B.1 mol NO2与足量H2O反应,转移的电子数为NA |
| C.常温常压下,9.2g的NO2和N2O4混合气体中含有的氮原子数为0.2 NA |
| D.高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数为0.4 NA |
C
解析试题分析:氯气做氧化剂,得到2个电子,则足量Fe与1 mol Cl2燃烧反应时,转移的电子数为2NA,A不正确;NO2和水反应的方程式是3NO2+H2O=2HNO3+NO,反应中转移2个电子,则1 mol NO2与足量H2O反应,转移的电子数为2/3NA,B不正确;NO2和N2O4的最简式都是NO2,所以常温常压下,9.2g的NO2和N2O4混合气体中含有的氮原子数为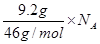 ,即为0.2 NA,C正确;SO2和氧气反应生成三氧化硫的反应是可逆反应,则高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数小于0.4 NA,D不正确,答案选C。
,即为0.2 NA,C正确;SO2和氧气反应生成三氧化硫的反应是可逆反应,则高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数小于0.4 NA,D不正确,答案选C。
考点:考查阿伏加德罗常数的有关计算和判断

设NA为阿伏加德罗常数的数值,则下列叙述正确的是
| A.1 mol氨基(—NH2)中含电子数为10NA |
| B.标准状况下,2.24 L18O2中所含中子的数目是2NA |
| C.标准状况下,22.4 L C8H18中含有的共价键键数为25NA |
| D.在反应CaO + 3C = CaC2 + CO↑中,每生成1 mol CO,转移的电子数为3NA |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B.常温常压下,22 g14CO2中所含分子数为0.5 NA |
| C.室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D.7.8g Na2O2与足量水反应,转移电子数为0.2NA |
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
| A.22.1 g | B.27.2 g | C.30 g | D.无法计算 |
NA代表阿伏加德罗常数的数值。下列有关NA的叙述中,正确的是
| A.1 mol 任何物质所含的分子数均为NA个 |
| B.14 g氮气所含的N原子数为NA个 |
| C.标准状况下,22.4 L水所含的H2O分子数为NA个 |
| D.在钠与氯气的反应中,1 mol钠失去电子的数目为2 NA个 |
1gN2含a个分子,则阿伏加德罗常数可表示为( )
| A.a/28mol-1 | B.a mol-1 | C.28a mol-1 | D.a/14 mol-1 |
对相同状况下的12C18O和14N2两种气体,下列说法正确的是 ( )
| A.若质量相等,则质子数相等 | B.若原子数相等,则中子数相等 |
| C.若分子数相等,则体积相等 | D.若体积相等,则密度相等 |
下列各项表达中,正确的是
A.水的电子式为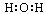 |
| B.将58g等体积的乙烯和乙烷混合物完全燃烧,生成的二氧化碳体积为89.6L |
| C.所有的氮原子中,质子数都是7个,但不一定是相同的原子 |
D.氯离子的结构示意图为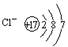 |
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,
并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+ )≈________mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是________。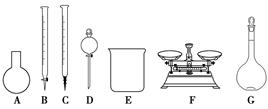
| A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |