题目内容
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )。
| A.Na+(g)+Cl-(g)=NaCl(s) ΔH |
B.Na(s)+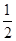 Cl2(g)=NaCl(s) ΔH1 Cl2(g)=NaCl(s) ΔH1 |
| C.Na(s)=Na(g) ΔH2 |
| D.Na(g)-e-=Na+(g) ΔH3 |
A
解析

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
根据下表中的数据,结合学过的化学知识,判断下列说法正确的是
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 沸点/℃ | 1465 | 1412 | 181(升华) | 57.6 |
B.若上述数据变化规律具有普遍性,则可预测:LiCl 的沸点大于BCl3的沸点
C.因为AlCl3的沸点低,所以工业上可用电解熔融AlCl3制备Al
D.据上述数据,可判断NaCl、MgCl2为分子晶体
金属的下列性质中与金属晶体结构无关的是( )
| A.导电性 | B.化学反应中易失去电子 |
| C.延展性 | D.硬度 |
“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。A165Cu23Fel2是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法错误的是:
| A.A165Cu23Fel2的硬度比金属A1、Cu、Fe都大 |
| B.A165Cu23Fel2中三种金属的化合价均可视作零 |
| C.A165Cu23Fel2不可用作长期浸泡在海水中的材料 |
| D.1mol A165Cu23Fel2溶于过量的硝酸时共失去265 mol电子 |
在下列四种有关性质的叙述中,可能属于金属晶体的是( )
| A.由分子间作用力结合而成,熔点低 |
| B.固体或熔融后易导电,熔点在1000℃左右 |
| C.由共价键结合成网状结构,熔点高 |
| D.固体不导电,但溶于水或熔融后能导电 |
用烧热的钢针去接触涂有薄薄一层石蜡的云母片的反面,熔化了的石蜡呈椭圆形,这是因为( )。
| A.云母是热的不良导体,传热不均匀 |
| B.石蜡是热的不良导体,传热不均匀 |
| C.石蜡具有各向异性,不同方向导热性能不同 |
| D.云母具有各向异性,不同方向导热性能不同 |
下列有关金属键的叙述错误的是( )。
| A.金属键没有饱和性和方向性 |
| B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用 |
| C.金属键中的电子属于整块金属 |
| D.金属的性质和金属固体的形成都与金属键有关 |
有关A1型密堆积与A3型密堆积的说法中正确的是( )。
| A.A1型密堆积是最密堆积,A3型密堆积不是最密堆积 |
| B.两者都是最密堆积,其中A3型密堆积是一、三、五……各层球心重合,二、四、六……各层球心重合;A1型密堆积是四、五、六各层球心分别和一、二、三各层球心重合 |
| C.原子晶体一般都采用A1型密堆积或A3型密堆积 |
| D.只有金属晶体才可能采用A1型密堆积或A3型密堆积 |