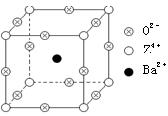
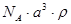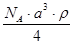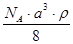题目内容
现有①BaCl2②金刚石③金属铜④KOH ⑤干冰⑥纯硫酸⑦二氧化硅⑧白磷⑨K2O ⑩NH4Cl十种物质,按下列要求回答(填序号):
⑴熔化时需要破坏共价键的是 ;
⑵属于分子晶体的是 ;
⑶固体不导电,常压下熔化时能导电的是 。
(1)2、7 (2)5、6、8 (3)1、4、9
解析试题分析:(1)熔化时破坏共价键的晶体应是原子晶体,金刚石、二氧化硅属于原子晶体,所以答案选2、7;
(2)干冰、纯硫酸、白磷属于分子晶体,答案选5、6、8;
(3)固体不导电,熔化时能导电的晶体是离子晶体,氯化钡、氢氧化钾、氧化钾、氯化铵是离子晶体,但氯化铵受热分解为氨气和氯化氢气体,所以答案选1、4、9。
考点:考查晶体类型的判断

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
下面有关晶体的叙述中,错误的是( )
| A.金刚石网状结构中,碳原子和共价键的个数比为1:2 |
| B.氯化钠晶体中,每个Na+周围距离相等的Cl-肯定为6个 |
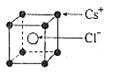
| C.氯化铯晶体中,每个Cs+周围紧邻6个Cs+ |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
形成物质世界多样性的原因有:( )
①元素种类 ②同位素 ③化学键成键方式 ④同分异构现象 ⑤同素异形现象
| A.仅①②③ | B.仅②④⑤ |
| C.仅①③ | D.①②③④⑤ |
Ⅰ下列描述中正确的是( )
| A.CS2为V形的极性分子 |
B.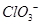 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有6对完全相同的成键电子对 |
D.SiF4和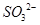 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
(1)Ni原子的核外电子排布式为__________________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,
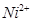 和
和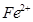 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);(3)NiO晶胞中Ni和O的配位数分别为_________________、_________________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________________;

(5)丁二酮肟常用于检验
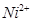 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与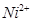 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________________。氮镍之间形成的化学键是_________________;
②该结构中,氧氢之间除共价键外还可存在_________________键;
③该结构中,碳原子的杂化轨道类型有_________________。
已知2H2(g)+O2(g)= 2H2O(l) ΔH=-569.6 kJ·mol-1, 2H2O(g)= 2H2(g)+O2(g) ΔH=+482.1 kJ·mol-1。现有1 g液态H2O,蒸发时吸收的热量是
| A.2.43 kJ | B.4.86 kJ | C.43.8 kJ | D.87.5 kJ |
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )。
| A.Na+(g)+Cl-(g)=NaCl(s) ΔH |
B.Na(s)+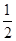 Cl2(g)=NaCl(s) ΔH1 Cl2(g)=NaCl(s) ΔH1 |
| C.Na(s)=Na(g) ΔH2 |
| D.Na(g)-e-=Na+(g) ΔH3 |