题目内容
【题目】FeCl2具有独有的脱色能力,适用于印染、造纸行业的污水处理。FeCl3在加热条件下遇水剧烈水解。FeCl3和FeCl2均不溶于C6H5Cl、C6H4Cl2、苯。回答下列问题:
(1)由FeCl3.6H2O制得干燥FeCl2的过程如下:
i.向盛有FeCl3.6H2O的容器中加入过量SOCl2(液体,易水解),加热,获得无水FeCl3。
ii.将无水FeCl3置于反应管中,通入一段时间的氢气后再加热,生成FeCl2。
①FeCl3.6H2O中加入SOCl2获得无水FeCl3的化学方程式为__________________。(已知该反应为非氧化还原反应)
②使用NH4SCN可以检验 ii中FeCl3是否含完全转化,请写出离子反应方程式_____________。
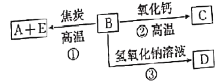
(2)利用反应2FeCl3 + C6H5Cl ![]() 2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)

①仪器B的名称是_________ ;C的试剂名称是________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经______、_______、干燥后,得到FeCl2粗产品。
③该装置存在的不足之处是__________________________。
(3)粗产品中FeCl2的纯度测定。
①取a g粗产品配制成100 mL溶液;②用移液管移取所配溶液5.00mL,放入500 mL锥形瓶内并加水至体积为200mL;③用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL。若已知消耗酸性高锰酸钾溶液为VmL,所配溶液的密度ρ(FeCl2)=kV ,密度的单位为g·L-1,则k=___________g·L-1·mL-1。
【答案】FeCl3.6H2O+6SOCl2![]() FeCl3+ 12HCl↑+6SO2↑ Fe3++3SCN-=Fe(SCN)3 或Fe3++SCN-=Fe(SCN)2+ (球形)冷凝管 水或氢氧化钠溶液 过滤 洗涤 装置B(或A)和C之间缺少一个装有无水氯化钙(P2O5或硅胶)的球形干燥管 12.7
FeCl3+ 12HCl↑+6SO2↑ Fe3++3SCN-=Fe(SCN)3 或Fe3++SCN-=Fe(SCN)2+ (球形)冷凝管 水或氢氧化钠溶液 过滤 洗涤 装置B(或A)和C之间缺少一个装有无水氯化钙(P2O5或硅胶)的球形干燥管 12.7
【解析】
(1)①SOCl2与水接触会迅速产生白雾和SO2,则FeCl3.6H2O中加入SOCl2获得无水FeCl3和HCl、SO2;
②Fe3+溶液中滴加含SCN-的溶液会变血红色;
(2)①根据仪器的结构和性能确定仪器的名称;C装置的作用是吸收挥发出的HCl气体;
②固液分离用过滤操作;
③FeCl3和FeCl2均易水解,要防止C中水蒸气进入A中;
(3)已知酸性条件下Fe2+被KMnO4溶液氧化时发生的离子反应方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL,则参加反应的MnO4-的物质的量为0.100 mol·L-1×V×10-3L=V×10-4mol,则ag粗产品中含有的Fe2+物质的量为V×10-4mol×5×![]() =V×10-2mol,溶液中FeCl2的质量为V×10-2mol×127g/mol=1.27Vg,所配溶液的密度ρ(FeCl2)=kV计算k。
=V×10-2mol,溶液中FeCl2的质量为V×10-2mol×127g/mol=1.27Vg,所配溶液的密度ρ(FeCl2)=kV计算k。
(1) ①SOCl2与水接触会迅速产生白雾和SO2,则FeCl3.6H2O中加入SOCl2获得无水FeCl3和HCl、SO2,则发生反应的化学方程式为6SOCl2+FeCl36H2O=FeCl3+12HCl↑+6SO2↑;
②利用NH4SCN检验溶液中是否含有Fe3+,判断FeCl3是否含完全转化,若不变红则完全转化,发生反应的离子方程式为Fe3++3SCN-=Fe(SCN)3 或Fe3++SCN-=Fe(SCN)2+;
(2)①由仪器的结构和性能可知:仪器B的名称是(球形)冷凝管;装置C中应盛装水或NaOH溶液吸收挥发的HCl气体;
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到FeCl2粗产品;
③该装置存在的不足之处是装置B(或A)和C之间缺少一个装有无水氯化钙(P2O5或硅胶)的球形干燥管,易造成C中水蒸气进入A中,促进FeCl3或FeCl2的水解;
(3)已知酸性条件下Fe2+被KMnO4溶液氧化时发生的离子反应方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL,则参加反应的MnO4-的物质的量为0.100 mol·L-1×V×10-3L=V×10-4mol,则ag粗产品中含有的Fe2+物质的量为V×10-4mol×5×![]() =V×10-2mol,溶液中FeCl2的质量为V×10-2mol×127g/mol=1.27Vg,则所配溶液的密度ρ(FeCl2)=
=V×10-2mol,溶液中FeCl2的质量为V×10-2mol×127g/mol=1.27Vg,则所配溶液的密度ρ(FeCl2)=![]() =kV,解得k=12.7g·L-1·mL-1。
=kV,解得k=12.7g·L-1·mL-1。

 名校课堂系列答案
名校课堂系列答案【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 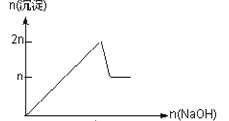
B. 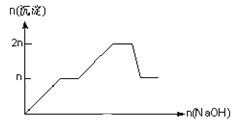
C. 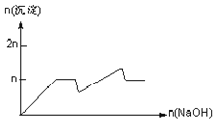
D.