题目内容
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,用化学用语回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)空气中含量最多的气体是____________;
(2)化学性质最不活泼的单质是 _________;
(3)Mg的原子结构示意图为_____________;
(4)C与O中,原子半径较小的是________ ;
(5)常用于制造光导纤维的是___________
(6)组成物质种类最多的元素是_________;
(7)H2S和H2O中,热稳定性较弱的是_________;
(8)元素最高价氧化物对应的水化物中,酸性最强的是_________
(9)钠的两种氧化物,分别是_________ 和 __________;
(10)写出铝的氧化物与氢氧化钠溶液反应的化学方程式___________________。
【答案】 N2 Ne 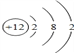 O SiO2 C H2S HClO4 Na2O Na2O2 Al2O3 + 2NaOH = 2 NaAlO2 +H2O
O SiO2 C H2S HClO4 Na2O Na2O2 Al2O3 + 2NaOH = 2 NaAlO2 +H2O
【解析】试题分析:(1)根据空气的成分回答;(2)最外层电子数为8的原子化学性质稳定;(3)根据核外电子排布规律书写Mg的原子结构示意图;(4)同周期元素从左到右半径减小;(5)光导纤维的成分是SiO2;(6)碳原子最外层有4个电子,能与其他原子形成4个共价键;(7)非金属性越强,气态氢化物越稳定;(8)非金属性越强,最高价氧化物对应的水化物酸性越强;(9)钠可以形成氧化钠、过氧化钠两种氧化物;(10)氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
解析:(1)空气中主要含有氮气、氧气,氮气占![]() ,空气中含量最多的气体是N2;(2)Ne最外层电子数为8,所以性质最稳定的是Ne;(3)Mg原子核外有12个电子,原子结构示意图是
,空气中含量最多的气体是N2;(2)Ne最外层电子数为8,所以性质最稳定的是Ne;(3)Mg原子核外有12个电子,原子结构示意图是 ;(4)C和O同周期,从左到右半径减小,所以半径较小的是O;(5)光导纤维的成分是SiO2,制造光导纤维的是SiO2;(6)碳原子最外层有4个电子,能与其他原子形成4个共价键,所以组成物质种类最多的元素是C;(7)非金属性越强,气态氢化物越稳定,O的非金属性大于S,所以H2S和H2O中,热稳定性较弱的是H2S;(8)非金属性越强,最高价氧化物对应的水化物酸性越强,酸性最强的是HClO4;(9)钠钠的两种氧化物,分别是Na2O和 Na2O2;(10)氧化铝与氢氧化钠溶液反应生成偏铝酸钠,反应方程式是Al2O3 + 2NaOH = 2 NaAlO2 +H2O;
;(4)C和O同周期,从左到右半径减小,所以半径较小的是O;(5)光导纤维的成分是SiO2,制造光导纤维的是SiO2;(6)碳原子最外层有4个电子,能与其他原子形成4个共价键,所以组成物质种类最多的元素是C;(7)非金属性越强,气态氢化物越稳定,O的非金属性大于S,所以H2S和H2O中,热稳定性较弱的是H2S;(8)非金属性越强,最高价氧化物对应的水化物酸性越强,酸性最强的是HClO4;(9)钠钠的两种氧化物,分别是Na2O和 Na2O2;(10)氧化铝与氢氧化钠溶液反应生成偏铝酸钠,反应方程式是Al2O3 + 2NaOH = 2 NaAlO2 +H2O;


