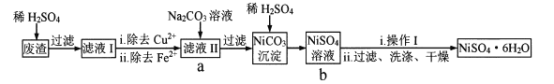
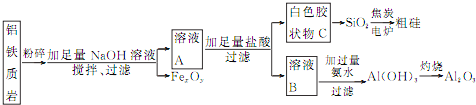
题目内容
【题目】为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究。请回答下列问题:
(一)甲组:实验方案:镁铝合金![]() 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托盘天平称量2.7g镁铝合金粉末
②溶解:将①中药品加入烧杯中,用量筒量取至少_____mL 1mol/L NaOH 溶液加入烧杯中,不断搅拌,充分反应
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将_____(填“偏高”、“偏低”或“不变”),证明固体已洗涤干净的方法为_________________________
⑤干燥、称量剩余固体
(二)乙组:

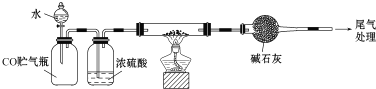
实验装置如图,实验步骤如下:
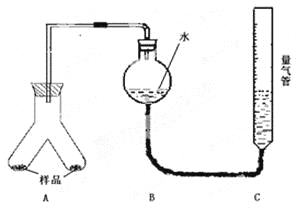
①按图连接好装置;
②称取两份质量均为0.3g 的镁铝合金样品粉末,分别放入A装置左右两个管中,向B装置中加入一定量的水,把装置A、B的胶塞塞好,然后调节C的高度使B和C中的液面相平,记录下此时的体积为112 mL;
③通过注射器的针头向装置A左侧管中注入足量的稀盐酸,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为448mL;
④通过另一针头向装置A右侧管中加入足量的稀NaOH溶液,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为672mL。
问题和讨论:
(1)上述实验步骤①和②之间必须加一步________的操作,具体方法为________________________。
(2)为使气体体积测定结果不至于引起很大偏差,除了应注意使B和C中的液面相平外,在反应完全后至读数之前,还需要注意的关键问题是(有几点写几点)_______。
(3)计算合金中铝的质量分数时,是否需要将气体体积折算为标准状况的体积____,试根据题中数据计算出合金中铝的质量分数为______。
【答案】100 偏低 取最后一次洗涤液逐滴滴加稀盐酸至过量,若滴加过程中始终无沉淀生成说明洗涤干净 检查装置的气密性 向C中加入一定量的水,然后提高C使C中液面高于B,静置一会儿,若液面不发生变化说明气密性良好 冷却到室温,平视读数 否 60%
【解析】
(一)若2.7g合金全部是Al,Al与氢氧化钠溶液的反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al的物质的量是0.1mol,则需要氢氧化钠物质的量也是0.1mol,需要1mol/LNaOH溶液的体积为100mL;剩余固体为Mg,若不洗涤,则Mg的质量偏大,则Al的质量偏小,所以Al的质量分数偏低;Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,则Mg固体可能含有偏铝酸根离子,所以证明Mg固体洗涤干净即证明固体中不含偏铝酸根离子,所以取最后一次洗涤液逐滴滴加稀盐酸至过量,若滴加过程中始终无沉淀生成说明洗涤干净。
(二)(1)上述实验步骤①和②之间必须加一步是检查装置的气密性,产生气体的装置必须先检查装置的气密性再装药品;利用压强的原理进行判断,方法是:向C中加入一定量的水,然后提高C使C中液面高于B,静置一会儿,若液面不发生变化说明气密性良好;
(2)该组实验利用产生氢气的体积来计算合金中金属的质量分数,金属与酸的反应是放热反应,温度升高,会影响C装置的读数,所以在反应完全后至读数之前,还需要注意的关键问题是冷却到室温,平视读数;
(3)设合金中Mg、Al的物质的量分别为x、y,则24g/molx+27g/moly=0.3g,生成氢气的物质的量之比等于体积之比,所以不需要将氢气的体积折算为标准状况;根据题意Al与氢氧化钠反应产生氢气的体积为672mL-448mL=224mL,Mg与Al和稀盐酸反应产生氢气的体积是448mL-112mL=336mL,等质量的Al与稀盐酸和NaOH溶液反应放出的H2相等,则Mg与盐酸反应产生氢气的体积为336mL-224mL=112mL,根据2Al~3H2,Mg~H2,所以x:![]() =112mL:224mL=1:2,解得x=0.005mol,则Mg的质量是0.005mol×24g/mol=0.12g,所以Al的质量是0.3g-0.12g=0.18g,则Al的质量分数是
=112mL:224mL=1:2,解得x=0.005mol,则Mg的质量是0.005mol×24g/mol=0.12g,所以Al的质量是0.3g-0.12g=0.18g,则Al的质量分数是![]() ×100%=60%。
×100%=60%。

【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变