题目内容
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
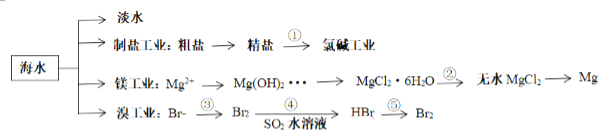
A. 海水制盐后可以利用氯碱工业,电解饱和食盐水制备金属钠
B. 在整个工艺制备过程中,未发生置换反应操作
C. 由 MgCl2·6H2O得到无水 MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
【答案】D
【解析】
A.电解饱和食盐水反应产生NaOH、H2、Cl2,不能反应制备金属钠,A错误;
B.海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,这两个反应都是置换反应,B错误;
C.MgCl2是强酸弱碱盐,在加热时结晶水变为溶剂水,Mg2+水解产生Mg(OH)2,为了抑制盐的水解,由 MgCl2·6H2O得到无水MgCl2是要在HCl的气氛中不断加热,就可以得到MgCl2,C错误;
D.海水提溴③是通入足量氯气氧化溴离子为溴单质,④是用SO2将溴单质还原为溴化氢,这两步目的是富集溴元素,然后再其溶液中通入适量氯气氧化溴离子为溴单质,在反应③、⑤中溴元素化合价升高,失去电子被氧化,反应④中被还原,在④中溴得电子化合价降低,所以溴元素被还原,D正确;
故合理选项是D。

【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol