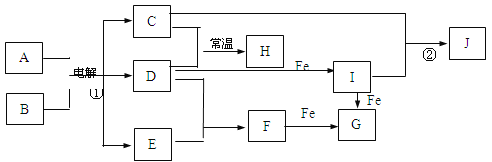
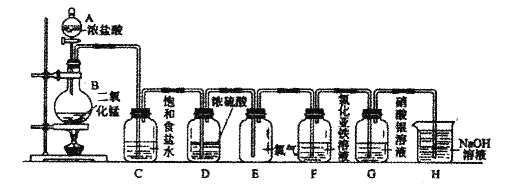
题目内容
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
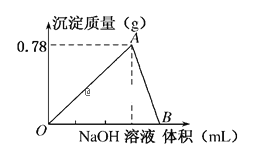
(1)图中A点表示的意义是___,此时消耗NaOH溶液的体积为___mL。
(2)图中B点表示的意义是___,相关反应的离子方程式为___。
【答案】Al3+完全生成Al(OH)3沉淀,沉淀达到最大值 15 Al(OH)3刚好完全溶解,铝元素以AlO2-形式存在 Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O
【解析】
由图可知,随着NaOH溶液的加入,溶液中发生由Al3+→Al(OH)3→AlO2-的转化。
(1)由图象可知,0~A发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,A点时Al3+完全沉淀,图中A点表示的意义是Al3+完全生成Al(OH)3沉淀,沉淀达到最大值;0.78gAl(OH)3的物质的量是![]() 0.01mol,根据反应方程式,消耗氢氧化钠的物质的量是0.03mol,消耗氢氧化钠溶液的体积是
0.01mol,根据反应方程式,消耗氢氧化钠的物质的量是0.03mol,消耗氢氧化钠溶液的体积是![]() 0.015L=15mL。
0.015L=15mL。
(2)由图象可知A~B发生Al(OH)3+NaOH═NaAlO2+2H2O,则B点时Al(OH)3刚好完全溶解;图中B点表示的意义是Al(OH)3刚好完全溶解,铝元素以AlO2-的形式存在;0~A发生反应的离子方程式是Al3++3OH-═Al(OH)3↓、A~B发生反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O。

【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸60.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | I | II | III | IV |
盐酸体积(mL) | 60.0 | 60.0 | 60.0 | 60.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中物质的量之比n(NaHCO3):n(Na2CO3)=___。
(2)盐酸的物质的量浓度c(HCl)=___。