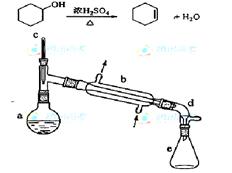
��Ŀ����
ij�л���A����NaOH��Һ��Ӧ��������к��б�������Է�������С��150�����к�̼����������Ϊ70.6%�������������Ϊ5.9%������Ϊ����
��1��A�ķ���ʽ�� ��
��2����A����NaHCO3��Һ��Ӧ�ų�CO2���壬��ṹ������ �֡�
��3����A��NaOH��Һ�ڼ���ʱ���ܽϿ췴Ӧ����1molA����1mol NaOH����A�����п��ܵĽṹ��ʽ�� ��
��4����A��NaOH��Һ�ڼ���ʱ���ܽϿ췴Ӧ����1mol A����2mol NaOH�������������A�Ľṹ������ �֣����в��ܷ���������Ӧ�����ʵĽṹ��ʽ�ǣ� ��
��1��A�ķ���ʽ�� ��
��2����A����NaHCO3��Һ��Ӧ�ų�CO2���壬��ṹ������ �֡�
��3����A��NaOH��Һ�ڼ���ʱ���ܽϿ췴Ӧ����1molA����1mol NaOH����A�����п��ܵĽṹ��ʽ�� ��
��4����A��NaOH��Һ�ڼ���ʱ���ܽϿ췴Ӧ����1mol A����2mol NaOH�������������A�Ľṹ������ �֣����в��ܷ���������Ӧ�����ʵĽṹ��ʽ�ǣ� ��
����8�ݣ���1�� C8H8O2��2�֣�2�� 4 �֡�
��3�� C6H5COOCH3��2��
��4�� 4 �֣�1�� CH3COOC6H5 ��2��
��3�� C6H5COOCH3��2��
��4�� 4 �֣�1�� CH3COOC6H5 ��2��
�����������1����������ã�n(C)=150��70.6%��12��8��n(H) =150��5.9%��1��8��n(O) =150��(1-70.6%-5.9%)��16��2����A�ķ���ʽ��C8H8O2��
��2��A�����к��б�����������NaHCO3��Һ��Ӧ�ų�CO2���壬A�����к���-COOH���ۺϷ������ṹ������4�֡�
��3��A��NaOH��Һ�ڼ���ʱ���ܽϿ췴Ӧ�����������к�����������ṹ��ʽΪC6H5COOCH3��
��4��A��NaOH��Һ�ڼ���ʱ���ܽϿ췴Ӧ����1mol A����2mol NaOH�����������к����������ṹ������4�֣����ܷ���������Ӧ�����ʵĽṹ��ʽ��CH3COOC6H5��
���������⿼������л�������л�������ʵ����֪ʶ����Ŀ�Ѷ��У�����ѧ���Ի���֪ʶ�����ճ̶ȼ�����������

��ϰ��ϵ�д�
 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
�����Ŀ