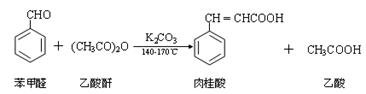
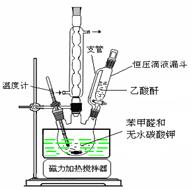
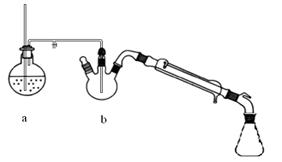
题目内容
将甲烷和氧气的混合气体充入含有23.4 g Na2O2的密闭容器中,保持容器中温度为150 ℃,用电火花引燃充分反应后,压强为0 Pa,若将残留物溶于水,无气体逸出。据此判断下列叙述正确的是( )
| A.原混合气体中甲烷和氧气体积比为1∶2 | B.原混合气体中甲烷和氧气体积比为2∶1 |
| C.残留固体中只有NaOH | D.残留固体中只有Na2CO3 |
B
试题分析:CH4+2O2=CO2+2H2O,2Na2O2+2H2O=4NaOH+O2↑和2Na2O2+2CO2=2Na2CO3+O2↑即(Na2O2+CO2=Na2CO3+
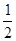 O2↑),有上述方程式可以知道,一个甲烷和两个氧气生成的产物与Na2O2反应生成了1.5个氧气,依据题意可知只需要0.5个氧气即可,所以甲烷和氧气体积比为2∶1,所以答案为B,残留固体中既有Na2CO3也有NaOH。
O2↑),有上述方程式可以知道,一个甲烷和两个氧气生成的产物与Na2O2反应生成了1.5个氧气,依据题意可知只需要0.5个氧气即可,所以甲烷和氧气体积比为2∶1,所以答案为B,残留固体中既有Na2CO3也有NaOH。点评:该题的综合性很强,具有一定的技巧性,本题有一定的难度。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目