题目内容
【题目】溴化锂是一种高效的水汽吸收剂,其一种绿色工业合成工艺如下(部分操作和条件已略去)。
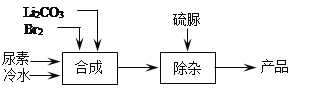
已知:碳酸锂微溶于水,水溶液显碱性。
(1)Br2的电子式是______。
(2)合成过程中发生的反应如下,请写出ii反应的化学方程式并将iii补充完整。
ⅰ. Br2 +H2O![]() HBr +HBrO;
HBr +HBrO;
ⅱ._____;
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+_____。
(3)LiBrO3是生产过程中的副产物。
①用化学方程式表示生成改副产物的原因:______。
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再______,直到尿素完全转化。
③常用硫脲除去LiBrO3,反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 ,选用硫脲除杂的优点是_______;缺点是引入新杂质且溶液酸性增强,为解决该问题需要加入的试剂是_______。
【答案】 ![]() Li2CO3 +2HBr= 2LiBr +H2O +CO2 ↑ CO2↑+N2↑+2H2O 3Br2 + 3Li2CO3 = 2LiBrO3 +5LiBr +3CO2 ↑ 少量多次交替加入Br2 和Li2CO3 可将LiBrO3转化为LiBr,并得到可以循环使用的CO(NH2)2 BaCO3
Li2CO3 +2HBr= 2LiBr +H2O +CO2 ↑ CO2↑+N2↑+2H2O 3Br2 + 3Li2CO3 = 2LiBrO3 +5LiBr +3CO2 ↑ 少量多次交替加入Br2 和Li2CO3 可将LiBrO3转化为LiBr,并得到可以循环使用的CO(NH2)2 BaCO3
【解析】(1)溴最外层有7个电子,Br2的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)合成过程中发生的反应如下:ⅰ. Br2 +H2O![]() HBr +HBrO;ⅱ.反应生成氢溴酸能够与碳酸锂生成溴化锂和二氧化碳,反应的方程式为Li2CO3 +2HBr= 2LiBr +H2O +CO2 ↑,ⅲ.HBrO与碳酸锂反应生成LiBrO,LiBrO具有强氧化性,将CO(NH2)2氧化生成二氧化碳和氮气,反应的方程式为3LiBrO + CO(NH2)2=3LiBr+ CO2↑+N2↑+2H2O,故答案为:Li2CO3 +2HBr= 2LiBr +H2O +CO2 ↑;CO2↑+N2↑+2H2O;
HBr +HBrO;ⅱ.反应生成氢溴酸能够与碳酸锂生成溴化锂和二氧化碳,反应的方程式为Li2CO3 +2HBr= 2LiBr +H2O +CO2 ↑,ⅲ.HBrO与碳酸锂反应生成LiBrO,LiBrO具有强氧化性,将CO(NH2)2氧化生成二氧化碳和氮气,反应的方程式为3LiBrO + CO(NH2)2=3LiBr+ CO2↑+N2↑+2H2O,故答案为:Li2CO3 +2HBr= 2LiBr +H2O +CO2 ↑;CO2↑+N2↑+2H2O;
(3)①LiBrO3是生产过程中的副产物,生成LiBrO3的反应方程式为3Br2 + 3Li2CO3 = 2LiBrO3 +5LiBr +3CO2 ↑,故答案为:3Br2 + 3Li2CO3 = 2LiBrO3 +5LiBr +3CO2 ↑;
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再少量多次交替加入Br2 和Li2CO3,直到尿素完全转化,故答案为:少量多次交替加入Br2 和Li2CO3;
③常用硫脲除去LiBrO3,反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 ,选用硫脲除杂的优点有可将LiBrO3转化为LiBr,并得到可以循环使用的CO(NH2)2;缺点是引入新杂质硫酸,且溶液酸性增强,为解决该问题,可以加入BaCO3除去硫酸,同时又不会引入新杂质,故答案为:可将LiBrO3转化为LiBr,并得到可以循环使用的CO(NH2)2;BaCO3。