题目内容
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号)。
(2)常温下0.01 mol/L HCl溶液的PH= ;PH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因 ,其溶液中离子浓度按由大到小的顺序为 。
(4)将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m n (填“大于、等于、小于”)。
(5)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
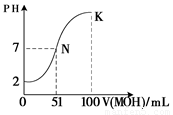
①由图中信息可知HA为_______酸(填“强”或“弱”)。
② K点对应的溶液中,
c(M+)+c(MOH)= mol·L-1。
(1)③④、②④⑤
(2) 2 、 10-3 mol/L
(3)CH3COO? + H2O  CH3COOH + OH?、
CH3COOH + OH?、
c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
(4) 小于
(5)① 强 ② 0.01
【解析】
试题分析:(1)①HCl ②NaOH ③CH3COOH ④NH3·H2O
⑤CH3COONa ⑥NH4Cl中, CH3COOH
、NH3·H2O属于弱电解质;NaOH、NH3·H2O、CH3COONa 溶液显碱性;(2)常温下0.01 mol/L HCl溶液的PH=-lg0.01=2,PH=11的CH3COONa溶液中的c(H+)=10-11mol/L,CH3COONa为强碱弱酸盐,所以由水电离产生的c(OH-)
=Kw/c(H+)=10-3
mol/L ;(3)CH3COONa为强碱弱酸盐,由于醋酸根的水解使得其溶液显碱性,其显碱性的离子方程式为CH3COO? + H2O  CH3COOH + OH?,根据电荷守恒可以得到c(H+)+c(Na+)=c(OH?)+c(CH3COO?),因为溶液显碱性,所以c(OH-)>c(H+),故溶液中离子浓度按由大到小的顺序为c(Na+)>c(CH3COO?)>c(OH-)>c(H+);(4)HCl为强酸,而醋酸为弱酸,所以将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m小于n;(5)由图可以知道, 0.01 mol·L-1HA溶液pH为2,所以HA为强酸;② K点对应的溶液中,根据物料守恒可以知道加入的MOH的物质的量为0.02×0.1=0.002mol,所以c(M+)+c(MOH)=0.002/0.2=0.01mol·L-1。
CH3COOH + OH?,根据电荷守恒可以得到c(H+)+c(Na+)=c(OH?)+c(CH3COO?),因为溶液显碱性,所以c(OH-)>c(H+),故溶液中离子浓度按由大到小的顺序为c(Na+)>c(CH3COO?)>c(OH-)>c(H+);(4)HCl为强酸,而醋酸为弱酸,所以将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m小于n;(5)由图可以知道, 0.01 mol·L-1HA溶液pH为2,所以HA为强酸;② K点对应的溶液中,根据物料守恒可以知道加入的MOH的物质的量为0.02×0.1=0.002mol,所以c(M+)+c(MOH)=0.002/0.2=0.01mol·L-1。
考点:强弱电解质、盐类水解、电荷守恒,物料守恒
点评:本题考查了强弱电解质、盐类水解、电荷守恒,物料守恒的相关知识,有一定的综合性,本题难度适中。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl