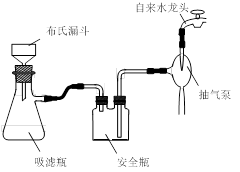
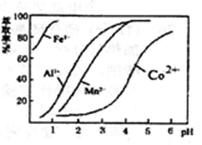
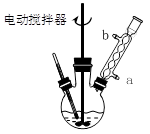题目内容
NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1) 第一步生产过程中发生反应的总化学方程式是 。
(2) 检验NaNO3成品中是否含少量的Na2CO3杂质的方法是
(3) 生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4) 生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为多少m3(标准状况下)。请写出计算过程。
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1) 第一步生产过程中发生反应的总化学方程式是 。
(2) 检验NaNO3成品中是否含少量的Na2CO3杂质的方法是
(3) 生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4) 生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为多少m3(标准状况下)。请写出计算过程。
(13分)(1) NO+3NO2+2Na2CO3===3NaNO2+NaNO3+2CO2(2分)
(2) 取少量NaNO3样品溶于水,滴入CaCl2溶液,若有白色沉淀生成,再加盐酸、沉淀又消失,说明有Na2CO3存在,否则无(2分)
(3) 0.96(3分)
(4)(4分)
设NO的物质的量为xmol,则NO2的物质的量为3xmol
因为3n(NO)+n(NO2)=4n(O2)即 3x+3x=4×1.5kmol
x=1kmol
n(NO)+n(NO2)=4kmol
V(尾气)=4×22.4/0.02%=4480m3
(2) 取少量NaNO3样品溶于水,滴入CaCl2溶液,若有白色沉淀生成,再加盐酸、沉淀又消失,说明有Na2CO3存在,否则无(2分)
(3) 0.96(3分)
(4)(4分)
设NO的物质的量为xmol,则NO2的物质的量为3xmol
因为3n(NO)+n(NO2)=4n(O2)即 3x+3x=4×1.5kmol
x=1kmol
n(NO)+n(NO2)=4kmol
V(尾气)=4×22.4/0.02%=4480m3
试题分析:(1)NO和NO2与碳酸化钠溶液反应,根据第二步流程,可知生成的产物中有还原性物质,所以产物有硝酸钠、亚硝酸钠、二氧化碳,则第一步生产过程中发生反应的总化学方程式是NO+3NO2+2Na2CO3===3NaNO2+NaNO3+2CO2
(2)检验NaNO3成品中是否含少量的Na2CO3杂质,即是检验碳酸根离子,常用试剂是氯化钙、氢氧化钙溶液,操作步骤是取少量NaNO3样品溶于水,滴入CaCl2溶液,若有白色沉淀生成,再加盐酸、沉淀又消失,说明有Na2CO3存在,否则不存在;
(3)根据元素守恒得Na2CO3~2NaNO3,所以0.65t的无水碳酸钠的利用率是x,则106:170=0.65x:1,解得x=0.96;
(4)33.6m3=33600L,所以生产1.0 t纯净的NaNO3固体,消耗氧气1500mol,根据得失电子守恒,NO和NO2失电子总数=氧气得电子总数,可以计算NO和NO2的物质的量,NO和NO2占尾气的2%,所以可计算生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积。具体步骤见答案。

练习册系列答案
相关题目



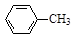 + 2KMnO4
+ 2KMnO4
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O + HCl
+ HCl
 +KCl
+KCl