题目内容
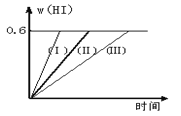
【题目】将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g) ![]() 2HI(g) △H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g) △H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)达平衡时,I2(g)的物质的量浓度为mol/L 。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是 ,则乙条件可能是 。(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;④恒温条件下,扩大反应容器体积;⑤恒温恒容条件下,加入正催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入2mol I2(g)、4mol H2(g)发生反应,达平衡时,HI的体积分数是 0.6(填大于、等于、小于)。
【答案】(1)0.05(2分);(2)③⑤、④(各1分);(3)等于(2分)
【解析】
试题分析:(1)该反应是一个反应前后气体体积不变的化学反应,所以反应后混合气体的物质的量是3mol,同一容器中各种气体的体积分数等其物质的量分数,所以平衡时碘化氢的物质的量=3mol×0.6=1.8mol,则参加反应的n(I2)=![]() n(HI),剩余的n(I2)=1mol﹣1.8mol×
n(HI),剩余的n(I2)=1mol﹣1.8mol×![]() =0.1mol,所以平衡时c(I2)=
=0.1mol,所以平衡时c(I2)=![]() =0.05mol/L,故答案为:0.05mol/L;
=0.05mol/L,故答案为:0.05mol/L;
(2)在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,反应时间缩短,碘化氢的含量不变,说明该条件只增大了反应速率不影响平衡,增大压强和加入催化剂对该反应平衡无影响,但都增大反应速率,缩短反应时间;在乙条件下w(HI)的变化如曲线(Ⅲ) 所示,反应时间变长,碘化氢的含量不变,说明反应速率减小,平衡不移动,所以是减小压强,即扩大容器体积,故答案为:③⑤;④;
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,与原来的平衡是等效平衡,恒温恒容,前后气体体积不变化,按化学计量数转化到左边,满足与原来加入的反应物物质的量比例相等即可;
对于反应 I2(g)+H2(g)![]() 2HI(g);
2HI(g);
开始(mol):a b c
变化(mol):![]() c
c ![]() c c
c c
平衡(mol):a+![]() c b+
c b+![]() c 0
c 0
则(a+![]() c ):( b+
c ):( b+![]() c)=1:2,
c)=1:2,
所以4a+c=2b,故答案为:4a+c=2b.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案