题目内容
5. A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.(1)试判断A、B、C、D四种元素的名称.A氢,B氧,C碳,D钠.
(2)A最高价氧化物的电子式为
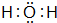 ,CB2的电子式为
,CB2的电子式为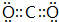 .
.(3)如图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞
迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到烧瓶内气球胀大,原因是CO2和NaOH溶液充分接触,发生反应:2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大.
分析 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子,则A为H元素;B是地壳中含量最多的元素,则B为O元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,则C为碳元素;D+具有与Ne原子相同的电子层结构,则D为Na,据此解答.
解答 解:A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子,则A为H元素;B是地壳中含量最多的元素,则B为O元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,则C为碳元素;D+具有与Ne原子相同的电子层结构,则D为Na.
(1)由上述分析可知,A为氢元素、B为氧元素、C为碳元素、D为钠元素,
故答案为:氢;氧;碳;钠;
(2)A最高价氧化物为H2O,电子式为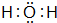 ,CO2的电子式为
,CO2的电子式为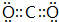 ,
,
故答案为: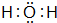 ;
;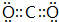 ;
;
(3)在烧瓶中收集满CO2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞,迅速倒入浓的NaOH溶液后,立即塞紧胶塞振荡,CO2和NaOH溶液充分接触,发生反应:2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大,
故答案为:烧瓶内气球胀大;CO2和NaOH溶液充分接触,发生反应:2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重学生对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.化学在生产和生活中有重要的应用.下列说法不正确的是( )
| A. | 小苏打在生活中可用做发酵粉 | B. | 电解MgCl2溶液可制金属镁 | ||
| C. | 可溶性铁盐或铝盐可用于水的净化 | D. | 二氧化硅可用于制作光导纤维 |
13.下列有机物命名正确的是( )
| A. | 3,3-二甲基丁烷 | B. | 2,2-二甲基丁烷 | ||
| C. | 2-乙基丁烷 | D. | 2,3,3-三甲基丁烷 |
20.下列物质均有漂白作用,其漂白原理相同的是( )
①二氧化硫
②次氯酸
③过氧化钠
④活性炭
⑤臭氧
⑥过氧化氢.
①二氧化硫
②次氯酸
③过氧化钠
④活性炭
⑤臭氧
⑥过氧化氢.
| A. | ①②⑤⑥ | B. | ①②③④ | C. | ②③⑤⑥ | D. | ①④ |
10.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
(2)除去反应混合物中的不溶物;
(3)电解混合液MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4;
下列说法不正确的是( )
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
(2)除去反应混合物中的不溶物;
(3)电解混合液MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4;
下列说法不正确的是( )
| A. | 步骤(1)中每析出12.8g S沉淀共转移0.4mol电子 | |
| B. | 步骤(1)中ZnS的还原性大于MnSO4的还原性 | |
| C. | 电解时MnO2在阳极处产生 | |
| D. | 硫酸在生产中可循环使用 |
17.将一定量的铝粉与氧化铜混合加热生成铜和氧化铝,充分反应后,为了检验氧化铜是否完全反应,取反应后的固体,加入足量的稀硫酸中,充分反应后,再将铁片插入溶液中,下列现象,能说明氧化铜没有完全反应的是( )
①加入稀硫酸有气泡产生 ②加入稀硫酸后,没有气泡生成 ③加入稀硫酸后,溶液中有红色不溶物出现 ④插入溶液中铁片表面有红色物质析出.
①加入稀硫酸有气泡产生 ②加入稀硫酸后,没有气泡生成 ③加入稀硫酸后,溶液中有红色不溶物出现 ④插入溶液中铁片表面有红色物质析出.
| A. | 只有②③ | B. | 只有③④ | C. | 只有④ | D. | ①②③④ |
14.工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
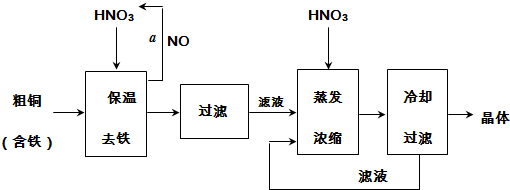
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是4NO+3O2+2H2O=4HNO3.
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7范围.若调节溶液的pH=4,此时,溶液中c (Fe3+)=4.0×10-6mol•L-1.[已知该条件下,Fe(OH)3的KSP=4.0×10-36]
(3)不用加水的方法调节溶液pH的原因是加水会将溶液稀释,不利于将滤液蒸发浓缩.
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明)由于Cu2+发生水解:Cu2++2H2O Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是Cu2++2e-=Cu.

(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是4NO+3O2+2H2O=4HNO3.
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7范围.若调节溶液的pH=4,此时,溶液中c (Fe3+)=4.0×10-6mol•L-1.[已知该条件下,Fe(OH)3的KSP=4.0×10-36]
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明)由于Cu2+发生水解:Cu2++2H2O
 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是Cu2++2e-=Cu.