��Ŀ����
����Ŀ����100��ʱ����0.200mol�������������������2L��յ��ܱ������У�ÿ��һ����ʱ��Ը������ڵ����ʽ��з������õ������
| 0 | 2 | 4 | 6 | 8 | 10 |
c��N2O4�� | 0.100 | c1 | 0.050 | c3 | a | b |
c��NO2�� | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
����գ�
��1���÷�Ӧ�ﵽƽ��ʱ��������������ת����Ϊ%������c2c3��ab�����������������=������
��2��2minʱ������������Ũ��c1=mol/L����0��2minʱ����ڣ�������������ƽ����Ӧ����Ϊmol/��Lmin����
��3��100��ʱ���÷�Ӧ��ƽ�ⳣ��K=
��4��������ͬ���������������������Ƕ����������壬Ҫ�ﵽ����ͬ����ƽ��״̬��������������ʼŨ����mol/L��
���𰸡�
��1��60��>��=
��2��0.070��0.015
��3��0.36
��4��0.200
���������⣺��1��ͼ�����ݷ�����֪��Ӧ�Ļ�ѧ����ʽΪ��N2O42 NO2 ��
�ɱ���֪��6minʱ��Ӧ��ƽ�⣬c��NO2��=0.120mol/L��
N2O4 | 2NO2 | ||
Ũ�ȱ仯 | 0.06mol/L | 0.120mol/L |
����ƽ��ʱN2O4��ת����Ϊ ![]() =60%��
=60%��
4minʱƽ�����ƣ�c2��c3 �� 60sʱc��NO2�����ٱ仯����Ӧ�ﵽƽ�⣬a=b��
���Դ��ǣ�60������=��
2���ɱ���֪��2minʱ��c��NO2 ��=0.060mol/L������
N2O4 | 2NO2 | ||
Ũ�ȱ仯 | 0.03mol/L | 0.060mol/L |
����2min��������������Ũ��c1=0.1mol/L��0.03mol/L=0.07mol/L��
��0��2min��������������ƽ����Ӧ����Ϊv��N2O4��= ![]() =0.015mol/��Lmin����
=0.015mol/��Lmin����
���Դ��ǣ�0.070��0.015��
3��
N2O4 | 2NO2 | ||
��ʼ��mol/L�� | 0.100 | 0 | |
�仯��mol/L�� | 0.060 | 0.120 | |
ƽ�⣨mol/L�� | 0.040 | 0.120 |
ƽ�ⳣ��k= ![]() =
= ![]() =0.36��
=0.36��
���Դ��ǣ�0.36��
4�����º��������£��ҷ�Ӧǰ����������ʵ��������仯����ʼ�������г�����Ƕ����������壬Ҫ�ﵽ��ͬ��ƽ��״̬������ѧ������ת����N2O4һ�ߣ�����N2O4��Ũ��Ϊ0.100mol/L����N2O4��g��2NO2��g����֪�����������ij�ʼŨ��=2��0.100mol/L=0.200mol/L��
���Դ��ǣ�0.200��
�����㾫����������Ĺؼ��������⻯ѧƽ��ļ�������֪ʶ�����շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��⣮ij�������Ƹ���ҵ������Cr�������������ù������£������Һ�н���������Ҫ��Cr3+ �� �����Fe3+ �� Fe2+ �� Al3+ �� Ca2+ �� Mg2+�� 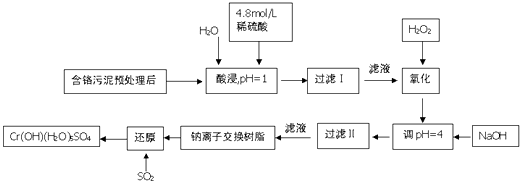
�����²��������ӵ����������γɳ���ʱ��Һ��pH���±���
������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
��ʼ����ʱ��pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | �� |
������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0����9.0�ܽ⣩ |
��1�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��������һ����
��2����pH=4.0��Ϊ�˳�ȥ����Fe3+ �� Al3+ �� Ca2+ �� Mg2+��
��3�������ӽ�����֬��ԭ��ΪMn++n NaR��MRn+nNa+ �� ����������������������Fe3+ �� Al3+ �� Ca2+ �� Mg2+��
��4������ƽ����������ԭ��Ӧ����ʽ��Na2Cr2O7+SO2+H2O=Cr��OH����H2O��5SO4+Na2SO4 ��


