题目内容
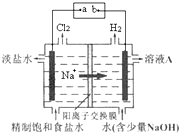
氯碱工业中电解饱和食盐水的原理示意图如图所示:
(1)电极a是电源的______.
(2)溶液A的溶质是(填化学式)______.
(3)电解饱和食盐水的离子方程式是______.
(4)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用______.
(5)电解所用的盐水需精制,去除盐水中的Ca2+、Mg2+、NH4+和SO42-,提供的试剂有①Na2CO3溶液②BaCl2溶液③NaOH溶液④HCl,加入试剂的顺序是______.
(1)电极a是电源的______.
(2)溶液A的溶质是(填化学式)______.
(3)电解饱和食盐水的离子方程式是______.
(4)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用______.
(5)电解所用的盐水需精制,去除盐水中的Ca2+、Mg2+、NH4+和SO42-,提供的试剂有①Na2CO3溶液②BaCl2溶液③NaOH溶液④HCl,加入试剂的顺序是______.

(1)装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,和电源正极相连,生成的氢气的电极为阴极,与电源负极相连,故答案为:正极;
(2)装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,a为正极,b为负极,连接电极为阴极,溶液中氢离子在阴极得到电子生成氢气,氢氧根离子浓度增大,溶液A为氢氧化钠溶液,故答案为:NaOH;
(3)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(4)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O?HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
故答案为:Cl2与水的反应为Cl2+H2O?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;
(5)先加入足量的③NaOH,除去镁离子,将HCO3-转化成碳酸根;然后加入过量②BaCl2,除去SO42-、CO32-;再加入过量①Na2CO3 除去Ca2+;过滤后,滤液中加入过量的④盐酸,除去溶液中剩余的碳酸根和氢氧化钠中的氢氧根,最后加热除去剩余的氯化氢,③②可以互换,故合理顺序是:③②①④或②③①④,
故答案为:②③①④或③②①④.
(2)装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,a为正极,b为负极,连接电极为阴极,溶液中氢离子在阴极得到电子生成氢气,氢氧根离子浓度增大,溶液A为氢氧化钠溶液,故答案为:NaOH;
(3)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O
| ||
| ||
(4)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O?HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
故答案为:Cl2与水的反应为Cl2+H2O?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;
(5)先加入足量的③NaOH,除去镁离子,将HCO3-转化成碳酸根;然后加入过量②BaCl2,除去SO42-、CO32-;再加入过量①Na2CO3 除去Ca2+;过滤后,滤液中加入过量的④盐酸,除去溶液中剩余的碳酸根和氢氧化钠中的氢氧根,最后加热除去剩余的氯化氢,③②可以互换,故合理顺序是:③②①④或②③①④,
故答案为:②③①④或③②①④.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目