题目内容
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是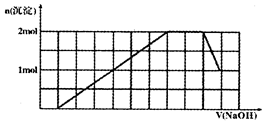
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中SO42-的物质的量至少为4.5mol |
| D.反应最后形成的溶液中含有的溶质为Na2SO4 |
C
解析试题分析:向该溶液中加入一定物质的量浓度的NaOH溶液时,开始无沉淀,说明溶液中含有H+离子,由于2H++CO32-=H2O+CO2↑,所以不含有CO32-;随着NaOH的加入,沉淀越来越多,当沉淀达到最大值时,沉淀的质量不再变化,说明发生反应NH4++OH-=NH3·H2O 。则含有NH4+;再继续加入沉淀又有所减少,说明含有Al3+,则根据图像可知n(Al3+)=1mol,产生沉淀Al(OH)3沉淀消耗NaOH的物质的量为3mol,使Al(OH)3沉淀溶解消耗NaOH为1mol,由图可看出1mol的NaOH占有的体积为1个格。在溶液中发生反应:Al3++3OH-=Al(OH)3↓; Al(OH)3 +OH-=AlO2-+2H2O.由于沉淀未完全溶解,说明还含有难溶性物质。该沉淀为1mol,产生该沉淀消耗NaOH为3mol,是Fe(OH)3则原溶液含有n(H+)="1mol;" n(NH4+)=2mol;n(Al3+)=1mol;n(Fe3+)="1mol." 根据溶液的电中性原理,则一定还含有SO42-。若原溶液中不含有Na+,则2n(SO42-)= n(H+)+ n(NH4+)+ 3n(Al3+)+3 n(Fe3+).="1+2+3×1+3×1=9mol," n(SO42-)="4." 5mol;若原溶液中含有Na+,则阴离子SO42-的物质的量还要增多。因此原溶液中SO42-的物质的量至少为4.5mol.由上述分析可知:反应到最后一定含有的物质为Na2SO4及NaAlO2。
考点:考查图像法在物质的鉴定中既含量的测定中的应用的知识。

 阅读快车系列答案
阅读快车系列答案正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.16O与18O互为同位素; 、 、 、 、 、 、 互为同素异形体 互为同素异形体 |
| B.SiH4、PH3、HCl的稳定性逐渐增强 |
| C.氧化铁的化学式:FeO |
D.Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为 |
设NA表示阿伏加德罗常数值,下列叙述正确的是
| A.常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA |
| B.标准状态下,54g H2O中含有分子数为3NA个 |
| C.0.1 mol·L-1的硫酸铝溶液所含的SO42-数就是0.3NA |
| D.NA个He分子所具有的体积为22.4L? |
下列变化中不属于化学变化的是( )。
| A.油脂的硬化 |
| B.S8受热后变为S2 |
| C.水泥制作水泥混凝土 |
D.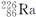 ―→ ―→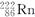 +He +He |
下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是( )。
| 溶液 | KOH | HNO3 | CH3COOH | HCl |
| 溶质质量分数w(%) | 56 | 63 | 60 | 36.5 |
| 物质的量浓度c(mol·L-1) | 14.3 | 13.8 | 10.6 | 11.8 |
A.HCl B.HNO3 C.CH3COOH D.KOH
将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)见图。下列说法正确的是( )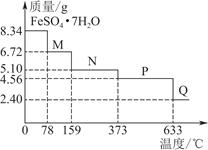
| A.FeSO4·7H2O晶体中有4种不同结合力的水分子 |
| B.在100 ℃时,M的化学式为FeSO4·6H2O |
| C.在200 ℃时,N的化学式为FeSO4·3H2O |
D.380 ℃的P加热至650 ℃的化学方程式为2FeSO4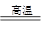 Fe2O3+SO2↑+SO3↑ Fe2O3+SO2↑+SO3↑ |
如图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶质的物质的量浓度为( )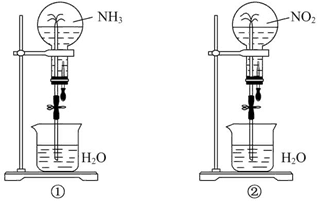
| A.①>② | B.①<② |
| C.①=② | D.不能确定 |
 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA