题目内容
正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.16O与18O互为同位素; 、 、 、 、 、 、 互为同素异形体 互为同素异形体 |
| B.SiH4、PH3、HCl的稳定性逐渐增强 |
| C.氧化铁的化学式:FeO |
D.Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为 |
B
解析试题分析:A、质子数相同中子数不同的同一种元素的不同核素互为同位素,由同一种元素形成的不同单质互为同素异形体,因此16O与18O互为同位素,而 、
、 、
、 、
、 不是同素异形体关系,A不正确;B、非金属性越强,相应氢化物的稳定性越强,非金属性强弱顺序是Si<P<Cl,所以SiH4、PH3、HCl的稳定性逐渐增强,B正确;C、氧化铁的化学式:Fe2O3,C不正确;D、NH4Cl的电子式为
不是同素异形体关系,A不正确;B、非金属性越强,相应氢化物的稳定性越强,非金属性强弱顺序是Si<P<Cl,所以SiH4、PH3、HCl的稳定性逐渐增强,B正确;C、氧化铁的化学式:Fe2O3,C不正确;D、NH4Cl的电子式为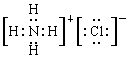 ,D不正确,答案选B。
,D不正确,答案选B。
考点:考查常见化学用语的正误判断

NA为阿伏加德罗常数,下列叙述正确的是
| A.10 g H218O含有的中子数为5NA |
| B.1 mol羟基(-OH)含有的电子数为10NA |
| C.1 mol 氯气参加反应时,电子转移数目一定为2NA |
| D.标准状况下,11.2L己烷含有的分子数为0.5 NA |
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是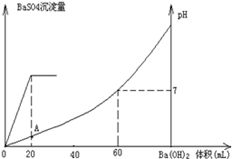
| A.图中A点溶液的pH=1 |
| B.生成沉淀的最大质量为2.33g |
| C.原混合溶液中盐酸物质的量浓度为0.1mol/L |
D.当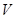 [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO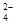 ═BaSO4↓ ═BaSO4↓ |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是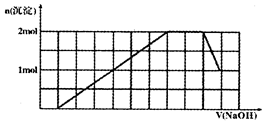
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中SO42-的物质的量至少为4.5mol |
| D.反应最后形成的溶液中含有的溶质为Na2SO4 |
一定量的铜和浓硫酸在加热条件下充分反应,向反应后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )
| A.溶液中c(Na+)=2c(SO42-) |
B. mol>沉淀的物质的量>0 mol>沉淀的物质的量>0 |
C.沉淀的物质的量= mol mol |
D.原浓硫酸中H2SO4的物质的量> mol mol |
如图是氨气与氯化氢反应的装置。抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )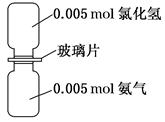
| A.气体反应物的总体积为0.224 L |
| B.生成物的分子个数为0.005NA |
| C.生成物中的N—H键个数为0.02NA |
| D.加水溶解后所得溶液中NH4+数目为0.005NA |
在200 mL某硫酸盐溶液中含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属阳离子,则该硫酸盐的物质的量浓度为( )
| A.1 mol/L | B.2.5 mol/L | C.5 mol/L | D.2 mol/L |
一定体积的溶质质量分数为14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质的质量分数恰好增大1倍,溶液体积变为62.5 mL。则浓缩后溶液的物质的量浓度为( )。
| A.2.2 mol·L-1 | B.4 mol·L-1 | C.5 mol·L-1 | D.6.25 mol·L-1 |
设NA表示阿伏加德罗常数的数值,下列判断正确的是( )
| A.常温常压下,22.4 L CH4中含有的C—H键数为4NA |
| B.4.6 g由NO2和N2O4组成的混合气体中含有的氧原子数为0.3NA |
| C.含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA |
| D.1 mol Na在足量O2中燃烧生成Na2O2,钠失去的电子数为NA |