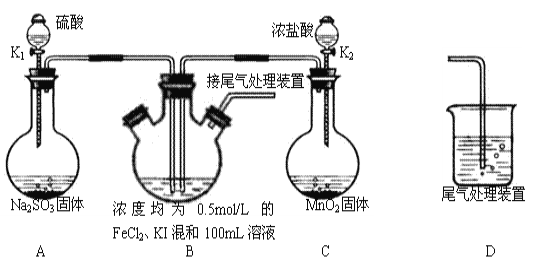
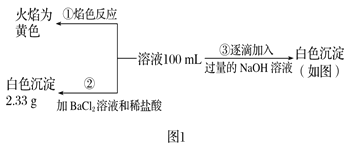
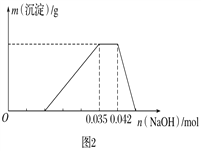
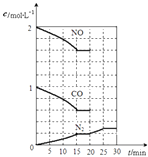
题目内容
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 32g O2和O3的混合气体含有的分子总数小于NA
B. 1mol CH3+(碳正离子)中含有电子数为10NA
C. 0.1mol氯化氢气体溶于水所得溶液中含有0.1NA个HCl分子
D. 1L 0.1mol/L 的葡萄糖溶液中,含有的分子数为NA个
【答案】A
【解析】A、32gO2的物质的量为![]() =1mol,分子数为NA,而含有O3,相同质量的O3所含分子数少,则分子总数减少,小于NA,选项A正确;B、 1mol CH3+(碳正离子)中含有电子数为8NA,选项B错误;C、氯化氢气体溶于水所得溶液不含HCl分子,选项C错误;D、1L 0.1mol/L 的葡萄糖溶液中,还有水分子,含有的分子数大于NA个,选项D错误。答案选A。
=1mol,分子数为NA,而含有O3,相同质量的O3所含分子数少,则分子总数减少,小于NA,选项A正确;B、 1mol CH3+(碳正离子)中含有电子数为8NA,选项B错误;C、氯化氢气体溶于水所得溶液不含HCl分子,选项C错误;D、1L 0.1mol/L 的葡萄糖溶液中,还有水分子,含有的分子数大于NA个,选项D错误。答案选A。

练习册系列答案
相关题目