题目内容
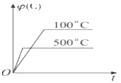
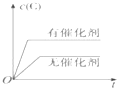
【题目】某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:


请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有____________________。
(2)实验③中所发生反应的离子反应方程式为___________________________。
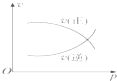
(3)依据图2判断出的原溶液中阳离子的种类及物质的量的比值为________。
(4)原溶液中NO3-是否存在?________ (“存在”、“不存在”或“不确定”)
【答案】 Fe3+、Mg2+、CO![]() H++OH-===H2O、Al3++3OH-===Al(OH)3↓、NH
H++OH-===H2O、Al3++3OH-===Al(OH)3↓、NH![]() +OH-===NH3·H2O、Al(OH)3+OH-===AlO
+OH-===NH3·H2O、Al(OH)3+OH-===AlO![]() +2H2O H+:NH4+:Al3+=2:1∶1 存在
+2H2O H+:NH4+:Al3+=2:1∶1 存在
【解析】试题分析:根据题意知,废水呈无色,说明废水中不存在Fe3+;实验①焰色反应显黄色,说明废水中含有Na+;实验②加入氯化钡和盐酸产生2.33g白色沉淀,说明废水中含有SO42-,且物质的量是2.33g÷233g/mol=0.01mol;实验③逐滴加入氢氧化钠,开始阶段没有沉淀产生,说明废水中含有H+,则一定没有CO32-;沉淀达到最大值后,继续加入氢氧化钠,沉淀的量不变,然后逐渐溶解,直到完全溶解,说明废水含有Al3+和NH4+,没有Mg2+。根据图像可知与NH4+反应的氢氧化钠是0.042mol-0.035mol=0.007mol,即NH4+是0.007mol。溶解氢氧化铝需要的氢氧化钠是0.007mol,则铝离子是0.007mol。而与氢离子反应的氢氧化钠是0.007mol×2=0.014mol;根据电中性原则判断废水中一定含有NO3-。(1)根据上述分析知废水中一定不存在的离子有:Fe3+、Mg2+、CO32-。(2)氢氧化钠溶解氢氧化铝阶段发生的离子反应方程式:Al(OH)3+OH-=AlO2-+2H2O;(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为1:1。废水中一定存在NO3-。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】在一密闭容器中加入A,B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:据此下列结论中正确的是( )
测定时刻/s | t1 | t2 | t3 | t4 |
C(A)/molL﹣1 | 6 | 3 | 2 | 2 |
C(B)/molL﹣1 | 5 | 3.5 | 3 | 3 |
C(C)/molL﹣1 | 1 | 2.5 | 3 | 3 |
A.在容器中发生的反应为2A(g)+B(g)2C(g)
B.该温度下,此反应的平衡常数为0.25
C.A的转化率比B转化率的低
D.在t3时刻反应已经停止