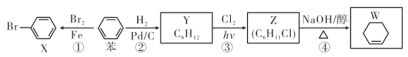
题目内容
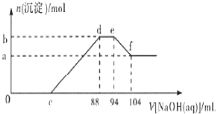
【题目】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
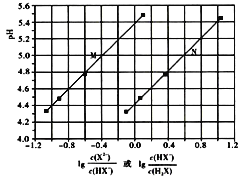
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
【答案】D
【解析】
H2X的电离方程式为H2X![]() H++HX-,HX-
H++HX-,HX-![]() H++X2-;当
H++X2-;当![]() =
=![]() =1时,即横坐标为0,0时,Ka1=c(H+),Ka2=c’(H+),因为Ka1>Ka2,故c(H+)>c’(H+),即pH<pH’,结合图象知,曲线N代表第一步电离,曲线M代表第二步电离。Ka2≈10-5.4,A项正确;由上述分析知,B项正确;选择曲线M分析,当NaHX、Na2X浓度相等时,溶液pH约为5.4,溶液呈酸性,所以NaHX溶液中c(H+)>c(OH-),C项正确;电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),中性溶液中存在c(H+)=c(OH-),故有c(Na+)=c(HX-)+2c(X2-),假设c(HX-)=c(X2-)或c(HX-)>c(X2-)(见C项分析),则溶液一定呈酸性,故中性溶液中c(HX-)<c(X2-),D项错误;
=1时,即横坐标为0,0时,Ka1=c(H+),Ka2=c’(H+),因为Ka1>Ka2,故c(H+)>c’(H+),即pH<pH’,结合图象知,曲线N代表第一步电离,曲线M代表第二步电离。Ka2≈10-5.4,A项正确;由上述分析知,B项正确;选择曲线M分析,当NaHX、Na2X浓度相等时,溶液pH约为5.4,溶液呈酸性,所以NaHX溶液中c(H+)>c(OH-),C项正确;电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),中性溶液中存在c(H+)=c(OH-),故有c(Na+)=c(HX-)+2c(X2-),假设c(HX-)=c(X2-)或c(HX-)>c(X2-)(见C项分析),则溶液一定呈酸性,故中性溶液中c(HX-)<c(X2-),D项错误;
故答案选D。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
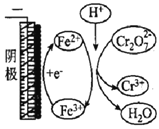
名师点睛字词句段篇系列答案【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g
【题目】如图为实验室中某些气体的制备、除杂、收集装置。用此装置能获得干燥纯净气体的是
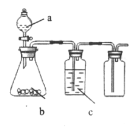
选项 | a | b | c | 气体 |
A | 浓盐酸 | Na2SO3 | 浓硫酸 | SO2 |
B | 稀硝酸 | Cu | 浓硫酸 | NO |
C | 浓盐酸 | MnO2 | 饱和食盐水 | Cl2 |
D | H2O2 | MnO2 | 浓硫酸 | O2 |
A.AB.BC.CD.D