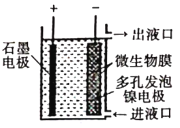
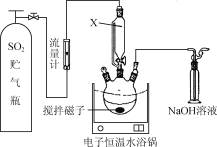
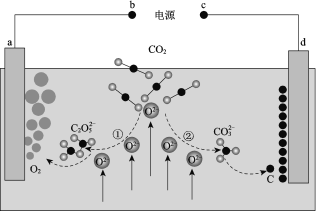
题目内容
【题目】下列溶液或浊液中,关于离子浓度的说法正确的是
A. 一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B. 浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)]
C. 0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+)
D. 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
【答案】C
【解析】
试题A、一定浓度的氨水加水稀释的过程中,氢氧根浓度减小,根据电离常数可知c(NH4+)/ c(NH3·H2O)=![]() ,温度不变,电离常数不变,氢氧根浓度减小,则比值增大,A错误; B、浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中碳酸根的水解程度大于碳酸氢根,则c(CO32-)<c(HCO3-),由于不能确定二者的体积,则3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]是错误的,B不正确;C、0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后醋酸过量,根据电荷守恒c(CH3COO-) +c(OH-) = c(Na+) + c(H+)和物料守恒c(CH3COO-) +c(CH3COOH)=2c(Na+)可知,溶液中c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+),C正确;D、常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,当Ag2CrO4悬浊液中的c(Ag+)不一定小于AgCl悬浊液中的c(Ag+),还需要考虑阴离子的浓度,D错误,故选C。
,温度不变,电离常数不变,氢氧根浓度减小,则比值增大,A错误; B、浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中碳酸根的水解程度大于碳酸氢根,则c(CO32-)<c(HCO3-),由于不能确定二者的体积,则3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]是错误的,B不正确;C、0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后醋酸过量,根据电荷守恒c(CH3COO-) +c(OH-) = c(Na+) + c(H+)和物料守恒c(CH3COO-) +c(CH3COOH)=2c(Na+)可知,溶液中c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+),C正确;D、常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,当Ag2CrO4悬浊液中的c(Ag+)不一定小于AgCl悬浊液中的c(Ag+),还需要考虑阴离子的浓度,D错误,故选C。

【题目】已知:一元弱酸HA的电离平衡常数K =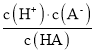 。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
化学式 | CH3COOH | HCN | H2CO3 |
K | 1.75×10–5 | 4.9×10–10 | K1 = 4.4×10–7 K2 = 5.6×10–11 |
下列说法正确的是
A. 稀释CH3COOH溶液的过程中,n(CH3COO–)逐渐减小
B. NaHCO3溶液中:c(H2CO3) < c(![]() ) < c(HCO3)
) < c(HCO3)
C. 25℃时,相同物质的量浓度的NaCN溶液的碱性强于CH3COONa溶液
D. 向CH3COOH溶液或HCN溶液中加入Na2CO3溶液,均产生CO2