题目内容
A、B、C、D分别为NH4HSO4、Ba(OH)2、AlCl3、Na2CO3 4种物质中的1种,溶于水均完全电离,现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a________b(填“>”“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为________(填化学式)。
(3)C溶液与D溶液反应的离子方程式为__________________________________________
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为________________________________________________________________________。
(5)已知沉淀甲的Ksp=x。将0.03 mol·L-1的A溶液与0.01 mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为________(用含x的代数式表示,混合后溶液体积变化忽略不计)。
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a________b(填“>”“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为________(填化学式)。
(3)C溶液与D溶液反应的离子方程式为__________________________________________
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为________________________________________________________________________。
(5)已知沉淀甲的Ksp=x。将0.03 mol·L-1的A溶液与0.01 mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为________(用含x的代数式表示,混合后溶液体积变化忽略不计)。
(1)Ba(OH)2 <
(2)Al2O3
(3)2Al3++3CO32—+3H2O=2Al(OH)3↓+3CO2↑
(4)正向 c(Na+)=c(SO42—)>c(NH4+)>c(H+)>c(OH-)
(5)100x mol/L
(2)Al2O3
(3)2Al3++3CO32—+3H2O=2Al(OH)3↓+3CO2↑
(4)正向 c(Na+)=c(SO42—)>c(NH4+)>c(H+)>c(OH-)
(5)100x mol/L
由A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲,说明乙为Al(OH)3,甲为BaSO4,A、B为强碱性溶液或强酸性溶液;由少量A溶液与C溶液混合可生成沉淀乙,则A为强碱,C为铝盐;A溶液与B溶液混合产生沉淀和刺激性气味气体,刺激性气味气体为NH3,B为铵盐,综合以上分析可得A为Ba(OH)2,B为NH4HSO4;C为AlCl3,D为Na2CO3。
(1)Ba(OH)2为强碱,稀释时没有平衡的移动,pH变化较大,而稀释Na2CO3时,CO32—的水解平衡右移,使其pH变化较小。
(2)加热蒸干AlCl3溶液时,Al3+的水解平衡右移,生成的盐酸挥发,导致水解彻底。
(3)Na2CO3溶液与AlCl3溶液混合,Al3+与CO32—发生相互促进的水解反应。
(4)硫酸氢铵电离出的H+使溶液呈酸性,水的电离受到抑制,加入NaOH溶液中和了H+,水的电离平衡被抑制的程度变小。反应完后所得溶液为等物质的量的(NH4)2SO4和Na2SO4的混合溶液,故离子浓度关系为c(Na+)=c(SO42—)>c(NH4+)>c(H+)>c(OH-)。
(5)混合反应后生成BaSO4,溶液为等体积混合,体积加倍,故混合液中c(Ba2+)=0.01 mol·L-1,则c(SO42—)=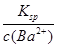 =
= =100x
=100x
(1)Ba(OH)2为强碱,稀释时没有平衡的移动,pH变化较大,而稀释Na2CO3时,CO32—的水解平衡右移,使其pH变化较小。
(2)加热蒸干AlCl3溶液时,Al3+的水解平衡右移,生成的盐酸挥发,导致水解彻底。
(3)Na2CO3溶液与AlCl3溶液混合,Al3+与CO32—发生相互促进的水解反应。
(4)硫酸氢铵电离出的H+使溶液呈酸性,水的电离受到抑制,加入NaOH溶液中和了H+,水的电离平衡被抑制的程度变小。反应完后所得溶液为等物质的量的(NH4)2SO4和Na2SO4的混合溶液,故离子浓度关系为c(Na+)=c(SO42—)>c(NH4+)>c(H+)>c(OH-)。
(5)混合反应后生成BaSO4,溶液为等体积混合,体积加倍,故混合液中c(Ba2+)=0.01 mol·L-1,则c(SO42—)=
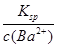 =
= =100x
=100x
练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
 CO2(g)+2H2O(l) ΔH ="-890" kJ/mol
CO2(g)+2H2O(l) ΔH ="-890" kJ/mol CH4(g)+O2(g)
CH4(g)+O2(g)