题目内容
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=________。(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题:
①若该水溶液由0.1 mol·L-1 HA溶液与0.1 mol·L-1NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是________。
③若该溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________。
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题:
①若该水溶液由0.1 mol·L-1 HA溶液与0.1 mol·L-1NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是________。
③若该溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
(1)1:1
(2)①大于或等于(或≥)
②大于(或>);
根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故c(Na+)>c(A-)
③AD
(2)①大于或等于(或≥)
②大于(或>);
根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故c(Na+)>c(A-)
③AD
(1)首先判断过量关系,反应后pH=1,说明酸过量,因此有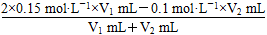 =0.1 mol·L-1,解得V1:V2=1:1。(2)①这里的HA酸有两种可能,假设它是强酸,则反应后溶液的pH=7,假设它是弱酸,则生成弱酸强碱盐,水解显碱性,pH>7,因此,混合溶液的pH大于或等于7。②若溶液pH>7,则c(Na+)>c(A-),因为c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故有c(Na+)>c(A-)。③该条件是HA溶液中的c(H+)和NaOH溶液中的c(OH-)相等,如果两溶液混合呈中性,则c(H+)=c(OH-)=1×10-7 mol·L-1,A正确;由于HA也可能是弱酸,所以若V1=V2,反应后溶液pH可能小于7,B错误;若反应后溶液呈酸性,说明H+过量,若HA是强酸,则V1>V2;若HA是弱酸,则酸的浓度肯定大于碱的浓度,浓度越大,则体积越小,V1、V2的大小关系不易确定,可能有V1≤V2,C错误;若反应后溶液呈碱性,则碱过量,无论酸是强酸还是弱酸,碱的体积均必须大于酸的体积,D正确,故选AD。
=0.1 mol·L-1,解得V1:V2=1:1。(2)①这里的HA酸有两种可能,假设它是强酸,则反应后溶液的pH=7,假设它是弱酸,则生成弱酸强碱盐,水解显碱性,pH>7,因此,混合溶液的pH大于或等于7。②若溶液pH>7,则c(Na+)>c(A-),因为c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故有c(Na+)>c(A-)。③该条件是HA溶液中的c(H+)和NaOH溶液中的c(OH-)相等,如果两溶液混合呈中性,则c(H+)=c(OH-)=1×10-7 mol·L-1,A正确;由于HA也可能是弱酸,所以若V1=V2,反应后溶液pH可能小于7,B错误;若反应后溶液呈酸性,说明H+过量,若HA是强酸,则V1>V2;若HA是弱酸,则酸的浓度肯定大于碱的浓度,浓度越大,则体积越小,V1、V2的大小关系不易确定,可能有V1≤V2,C错误;若反应后溶液呈碱性,则碱过量,无论酸是强酸还是弱酸,碱的体积均必须大于酸的体积,D正确,故选AD。
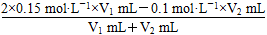 =0.1 mol·L-1,解得V1:V2=1:1。(2)①这里的HA酸有两种可能,假设它是强酸,则反应后溶液的pH=7,假设它是弱酸,则生成弱酸强碱盐,水解显碱性,pH>7,因此,混合溶液的pH大于或等于7。②若溶液pH>7,则c(Na+)>c(A-),因为c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故有c(Na+)>c(A-)。③该条件是HA溶液中的c(H+)和NaOH溶液中的c(OH-)相等,如果两溶液混合呈中性,则c(H+)=c(OH-)=1×10-7 mol·L-1,A正确;由于HA也可能是弱酸,所以若V1=V2,反应后溶液pH可能小于7,B错误;若反应后溶液呈酸性,说明H+过量,若HA是强酸,则V1>V2;若HA是弱酸,则酸的浓度肯定大于碱的浓度,浓度越大,则体积越小,V1、V2的大小关系不易确定,可能有V1≤V2,C错误;若反应后溶液呈碱性,则碱过量,无论酸是强酸还是弱酸,碱的体积均必须大于酸的体积,D正确,故选AD。
=0.1 mol·L-1,解得V1:V2=1:1。(2)①这里的HA酸有两种可能,假设它是强酸,则反应后溶液的pH=7,假设它是弱酸,则生成弱酸强碱盐,水解显碱性,pH>7,因此,混合溶液的pH大于或等于7。②若溶液pH>7,则c(Na+)>c(A-),因为c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故有c(Na+)>c(A-)。③该条件是HA溶液中的c(H+)和NaOH溶液中的c(OH-)相等,如果两溶液混合呈中性,则c(H+)=c(OH-)=1×10-7 mol·L-1,A正确;由于HA也可能是弱酸,所以若V1=V2,反应后溶液pH可能小于7,B错误;若反应后溶液呈酸性,说明H+过量,若HA是强酸,则V1>V2;若HA是弱酸,则酸的浓度肯定大于碱的浓度,浓度越大,则体积越小,V1、V2的大小关系不易确定,可能有V1≤V2,C错误;若反应后溶液呈碱性,则碱过量,无论酸是强酸还是弱酸,碱的体积均必须大于酸的体积,D正确,故选AD。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 与上述混合溶液中
与上述混合溶液中 相等
相等
 O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题: ,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。