��Ŀ����
����Ŀ��CO2���ۺ����ö��ڼ����������塢������Դ��ȱ������Ҫ�����塣
����CO2�������ȶ��������ʽΪ___��
���ྦྷCu��Ψһ��ʵ��֤ʵ�ܸ�Ч��CO2��ԭΪ����(��CH4 ��C2H4)�Ľ��������װ�÷ֱ��ԶྦྷCu�Ͳ�Ϊ�缫���ϣ��������ӽ���Ĥ�ָ������������ң����������ҵ�KHCO3��Һ��Ũ��(Լ0.1 mol/L����)�������ֲ��䡣����ij�����ڳ���ͨ��CO2���¶ȿ�����10�����ҡ�
(1)����ͨ��CO2��ԭ����______��
(2)�о������������Ķ������ؾ�����C2H4��ѡ���Ժʹ����ԡ�
��֪��ѡ����=Ŀ����������ԭ����/ԭ���ܵ�ת����
�ڱ�ʵ�������£�����C2H4�ĵ缫��ӦΪ______��
(3)��ʵ�������£���CO2ת��Ϊ����ת����Ϊ10%������C2H4��ѡ����Ϊ12%�����ռ���12 mol C2H4����ͨ���CO2Ϊ______mol��
����CO2��CH4�����������Ƶúϳ�����CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H
2CO(g)+2H2(g) ��H
(1)��֪����Ӧ1��CH4(g) �TC(s)+2H2(g) ��H1=+75kJmol��1
��Ӧ2��H2(g) + CO2(g)![]() H2O(g)+CO(g) ��H2=+35kJmol��1
H2O(g)+CO(g) ��H2=+35kJmol��1
��Ӧ3��2CO(g) �TC(s)+ CO2(g) ��H3=��172kJmol��1
��ô�������Ӧ�ġ�H=___kJmol��1�����¶Ⱥ�ѹǿ�Ƕ����������CO2ƽ��ת���ʵ�������____��
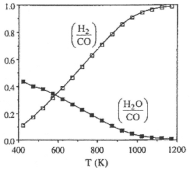
(2)��ͼ��ʾ��ϵ��c(H2)/c(CO)��c(H2O)/c(CO)�ı仯����������1200K����c(H2)/c(CO)С��1��ԭ��___�����������¶ȵ�����c(H2)/c(CO)�����ԭ��____��
���𰸡�![]() ���CO2��Ũ�ȣ�����CO2�ķŵ�����������H+�ķŵ� 14CO2+12e-+8H2O= C2H4+12HCO3- 1000 +247 ���µ�ѹ ��Ϊ�����˷�Ӧ2 H2(g) + CO2(g)
���CO2��Ũ�ȣ�����CO2�ķŵ�����������H+�ķŵ� 14CO2+12e-+8H2O= C2H4+12HCO3- 1000 +247 ���µ�ѹ ��Ϊ�����˷�Ӧ2 H2(g) + CO2(g)![]() H2O(g) +CO(g) ���¶ȵ����ߣ�CH4(g)+CO2(g)
H2O(g) +CO(g) ���¶ȵ����ߣ�CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H>0��ƽ�����ƣ�COŨ��������CO2Ũ�Ƚ��ͣ���Ӧ2ƽ�����ƣ���ͼ��c(H2O)/ c(CO)��С�õ���֤���Ӷ�c(H2)/ c(CO)����
2CO(g)+2H2(g) ��H>0��ƽ�����ƣ�COŨ��������CO2Ũ�Ƚ��ͣ���Ӧ2ƽ�����ƣ���ͼ��c(H2O)/ c(CO)��С�õ���֤���Ӷ�c(H2)/ c(CO)����
��������
��CO2�ǹ��ۻ�����������̼��ÿ����ԭ��֮����ڶ������õ��Ӷԣ�
��(1)����ͨ��CO2�����CO2�����Ũ�ȣ�ȷ��������������CO2�Ļ�ԭ��Ӧ��
(2) CO2�ڵ��ص������õ��ӷ�����ԭ��Ӧ����C2H4��
(3)��CO2ת��Ϊ����ת����Ϊ10%������C2H4��ѡ����Ϊ12%�����ѡ����=Ŀ����������ԭ����/ԭ���ܵ�ת��������μӷ�Ӧ��CO2�����ʵ�����
��(1)���ݸ�˹���ɼ�����H������¶Ⱥ�ѹǿ��ƽ���Ӱ�죬�����ٽ�ƽ�������ƶ���������
(2)����¶ȶԷ�Ӧ2��H2(g) + CO2(g)![]() H2O(g)+CO(g) ��H2=+35kJmol��1��CH4(g)+CO2(g)
H2O(g)+CO(g) ��H2=+35kJmol��1��CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H=+247 kJmol��1��ƽ��״̬��Ӱ�������
2CO(g)+2H2(g) ��H=+247 kJmol��1��ƽ��״̬��Ӱ�������
��CO2�ǹ��ۻ���������ʽΪ![]() ��
��
��(1)����ͨ��CO2��Ŀ����Ϊ�����CO2��Ũ�ȣ�����CO2�ķŵ�����������H+�ķŵ磬ȷ��������������CO2�Ļ�ԭ��Ӧ��
(2)CO2�ڵ��ص������õ��ӷ�����ԭ��Ӧ����C2H4�������ĵ缫��ӦΪ14CO2+12e-+8H2O=C2H4+12HCO3-��
(3)��μӷ�Ӧ��CO2�����ʵ���Ϊnmol������ѡ����=Ŀ����������ԭ����/ԭ���ܵ�ת������֪��12%=![]() ����ã�n=1000mol��
����ã�n=1000mol��
��(1)��֪����Ӧ1��CH4(g) �TC(s)+2H2(g) ��H1=+75kJmol��1����Ӧ3��2CO(g) �TC(s)+ CO2(g) ��H3=��172kJmol��1�����ݸ�˹���ɣ��ɷ�Ӧ1-��Ӧ3���ɵõ�CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)������H=(+75kJmol��1)-(��172kJmol��1)=+247 kJmol��1���Է�ӦCH4(g)+CO2(g)
2CO(g)+2H2(g)������H=(+75kJmol��1)-(��172kJmol��1)=+247 kJmol��1���Է�ӦCH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H=+247 kJmol��1�������¶Ⱥͽ���ѹǿ���ܴٽ�ƽ�������ƶ��������CO2ƽ��ת���ʵ������Ǹ��µ�ѹ��
2CO(g)+2H2(g) ��H=+247 kJmol��1�������¶Ⱥͽ���ѹǿ���ܴٽ�ƽ�������ƶ��������CO2ƽ��ת���ʵ������Ǹ��µ�ѹ��
(2)��Ӧ��ϵ�з����ķ�Ӧ2��H2(g) + CO2(g)![]() H2O(g)+CO(g) ��H2=+35kJmol��1���¶Ƚϵ�ʱ�����ڴ˷�Ӧ������У�ʹ��ϵ��c(H2)��Ũ�Ƚ��ͣ�
H2O(g)+CO(g) ��H2=+35kJmol��1���¶Ƚϵ�ʱ�����ڴ˷�Ӧ������У�ʹ��ϵ��c(H2)��Ũ�Ƚ��ͣ�![]() 2CO(g)+2H2(g) ��H>0��ƽ�����ƣ�COŨ��������CO2Ũ�Ƚ��ͣ���Ӧ2ƽ�����ƣ���ͼ��c(H2O)/c(CO)��С�õ���֤���Ӷ�c(H2)/c(CO)����
2CO(g)+2H2(g) ��H>0��ƽ�����ƣ�COŨ��������CO2Ũ�Ƚ��ͣ���Ӧ2ƽ�����ƣ���ͼ��c(H2O)/c(CO)��С�õ���֤���Ӷ�c(H2)/c(CO)����