题目内容
【题目】许多变化中存在着能量的变化,请回答下列问题:
(1)从化学键角度上看,化学反应的本质是____________。
已知反应2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
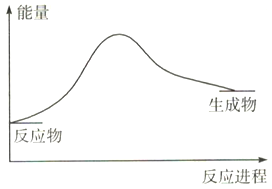
则反应中断裂的化学键是_______(用相应化学键的符号表示),该反应是_____(填“吸热”或“放热”)反应。4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
(2)写出一个属于吸热反应的化学方程式:______________。
【答案】 旧化学键的断裂与新化学键的形成 O-H、N≡N 吸热 > C+CO2![]() 2CO(其他合理答案均可)
2CO(其他合理答案均可)
【解析】(1)从化学键角度上看,化学反应的本质为旧化学键的断裂与新化学键的形成;根据2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g),反应中断裂的化学键有O-H、N≡N,根据图示,反应物的总能量低于生成物的总能量,该反应是吸热反应,则4NH3(g)+3O2(g)
4NH3(g)+3O2(g),反应中断裂的化学键有O-H、N≡N,根据图示,反应物的总能量低于生成物的总能量,该反应是吸热反应,则4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(1)为放热反应,反应中反应物的总能量>生成物的总能量;故答案为:旧化学键的断裂与新化学键的形成;O-H、N≡N;吸热;>;
2N2(g)+6H2O(1)为放热反应,反应中反应物的总能量>生成物的总能量;故答案为:旧化学键的断裂与新化学键的形成;O-H、N≡N;吸热;>;
(2)属于吸热反应的有氢氧化钡晶体与氯化铵固体的反应、碳与二氧化碳的反应,氢气还原氧化铜的反应等,故答案为:C+CO2![]() 2CO(其他合理答案均可)。
2CO(其他合理答案均可)。

【题目】在25℃时,密闭容器中X,Y,Z三种气体的起始浓度和平衡浓度如表,下列说法错误的是( )
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.改变温度可以改变该反应的平衡常数
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀盐酸 | 锌粒 | H2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D



