题目内容
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
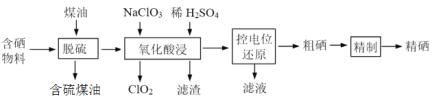
回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。

(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。

①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为___________,与粗硒中铁含量为0.89%相比,铁含量明显降低。
【答案】温度升高,单质硫在煤油中的溶解度增加 95℃ 4ClO3-+ 4H+ + Se = 4ClO 2↑+ H2O + H2SeO3 ClO2 + 4H+ + 5e- = Cl- + 2H2O 0.345 5.0×10-35 mol·L-1 Na2SeSO3 + H2SO4 = Na2SO4 + Se↓+ SO2↑+ H2O 3.2×10-3 %
【解析】
硒酸泥(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)加入热煤油萃取硫,固体加入稀硫酸、氯酸钠进行氧化,过滤,滤渣中含有氢氧化铁、二氧化硅,氧化浸出液含有H2SeO3,控制电位还原,发生氧化还原反应可生成Se。
(1)“脱硫”时,脱硫率随着温度的升高,脱硫率呈上升趋势,其原因是温度升高,单质硫在煤油中的溶解度增加。最佳温度是95℃。
(2)“氧化酸浸”中,固体加入稀硫酸、氯酸钠进行氧化,Se转化成H2SeO3,ClO3-还原成ClO 2,该反应的离子方程式为4ClO3-+ 4H+ + Se = 4ClO 2↑+ H2O + H2SeO3 。
(3)①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2,ClO2得电子还原成Cl-,该过程的还原反应(半反应)式为ClO2 + 4H+ + 5e- = Cl- + 2H2O。
②为使硒和杂质金属分离,确保Cu2+、Zn2+、Fe2+不被还原,用亚硫酸钠还原时的最低电位应控制在0.345V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为c(Cu2+)=![]() =
=![]() =5.0×10-35 mol·L-1 ,精硒中基本不含铜。
=5.0×10-35 mol·L-1 ,精硒中基本不含铜。
②硒代硫酸钠酸化生成硒、二氧化硫和水,化学方程式为Na2SeSO3 + H2SO4 = Na2SO4 + Se↓+ SO2↑+ H2O 。
(5)精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数==![]() 3.2×10-3 %,与粗硒中铁含量为0.89%相比,铁含量明显降低。
3.2×10-3 %,与粗硒中铁含量为0.89%相比,铁含量明显降低。

【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟强碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_____。
(2)元素Y与氢元素形成一种离子YH4+,写出某溶液中含该微粒的电子式_____,如何检验该离子_____。
(3)元素Z在周期表中的位置_____,元素Z与元素T相比,非金属性较强的是_____(用元素符号表示),下列表述中能证明这一事实的是_____(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质性质的差异性是学习化学的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是_____,理由是_________。Z的最高价氧化物的水化物与W的最高价氧化物的水化物反应的离子方程式为_____________。




