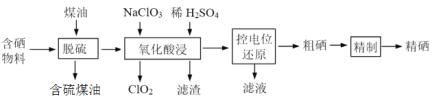
题目内容
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。

(1)Y的化学式为___。
(2)图中X的电子式为___;其水溶液长期在空气中放置容易变浑浊,原因是___(用化学方程式表示);该变化体现出:S非金属性比O___(填“强”或“弱”)。用原子结构解释原因:同主族元素从上到下,___,得电子能力逐渐减弱。
(3)Z与图表中某物质反应生成SO2的化学方程式是___。
【答案】SO3 ![]() 2H2S+O2=2S↓+2H2O 弱 半径逐渐增大,核内质子数对核外电子的束缚能力逐渐减弱 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
2H2S+O2=2S↓+2H2O 弱 半径逐渐增大,核内质子数对核外电子的束缚能力逐渐减弱 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
【解析】
(1)+6价硫元素的氧化物为SO3;
(2)-2价硫元素的气态氢化物为H2S,其电子式为:![]() ;-2价硫元素具有较强的还原性,能够与空气中氧气发生氧化还原反应生成硫单质,其溶液长期在空气中放置容易变浑浊,其反应为:2H2S+O2=2S↓+2H2O;硫的氧化物中,硫元素呈正价,氧元素呈负价,由此可知非金属性O>S;同主族元素最外层电子数相同,从上至下电子层数逐渐增加,半径逐渐增大,核内质子数对核外电子的束缚能力逐渐减弱,因此其得电子能力逐渐减弱;
;-2价硫元素具有较强的还原性,能够与空气中氧气发生氧化还原反应生成硫单质,其溶液长期在空气中放置容易变浑浊,其反应为:2H2S+O2=2S↓+2H2O;硫的氧化物中,硫元素呈正价,氧元素呈负价,由此可知非金属性O>S;同主族元素最外层电子数相同,从上至下电子层数逐渐增加,半径逐渐增大,核内质子数对核外电子的束缚能力逐渐减弱,因此其得电子能力逐渐减弱;
(3)Na2SO3中S元素呈+4价,Na2SO3为强碱弱酸盐,能与非氧化性酸反应生成SO2,其反应方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目