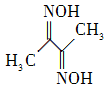
题目内容
(11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
还可以验证E、F两种元素非金属强弱的是(填写字母)
A.比较这两种元素的常见单质的沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸性
(3) A、C、E两两之间可形成甲、乙两种微粒,它们均为带一个单位负电荷的双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(第1空1分,其余空2分)
(1) 第三周期ⅦA族;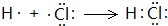 ;185
;185
(2)Cl2+S2-=2Cl-+S↓或Cl2+H2S=2H++2Cl-+S↓ ; BC
(3)HS-+OH-=S2-+H2O
解析试题分析:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A有多种核素,其中一种没有中子,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;E元素原子的最外层电子数是其次外层电子数的3/4,最外层电子数为6,则E为S元素;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O元素;F原子序数最大,则F为Cl元素;(1)F为Cl元素,在元素周期表中的位置是:第三周期ⅦA族;H与Cl两种元素组成的化合物为HCl,用电子式表示HCl的形成过程为: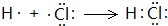 ,反应方程式为H2+Cl2=2HCl,反应生成2mol产物时释放的能量=2×432kJ-(436kJ+243kJ)=185kJ;(2)用离子方程式表示S、Cl两种元素的非金属性强弱为:Cl2+S2-=S↓+2Cl-,可以根据单质与氢气反应的难易程度及最高价氧化物对应水化物的酸性强弱比较非金属性强弱,单质沸点属于物理性质,不能比较非金属性强弱,故A错误,BC正确;(3)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O。
,反应方程式为H2+Cl2=2HCl,反应生成2mol产物时释放的能量=2×432kJ-(436kJ+243kJ)=185kJ;(2)用离子方程式表示S、Cl两种元素的非金属性强弱为:Cl2+S2-=S↓+2Cl-,可以根据单质与氢气反应的难易程度及最高价氧化物对应水化物的酸性强弱比较非金属性强弱,单质沸点属于物理性质,不能比较非金属性强弱,故A错误,BC正确;(3)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O。
考点:考查元素位置、结构与性质的关系,以及元素金属性非金属性强弱比较、化学键、电子式等相关知识。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式)。
(3)①、②、③三种元素按离子半径由大到小的顺序依次为 (填离子符号)。
(4)⑥元素形成的具有强氧化性的氢化物电子式是 , 该元素另一种氢化物在常温下与 ②发生反应的化学方程式为 。
(16分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
| | | | |||||||||||||||
| | | | | h | | | | | |||||||||
| a | c | f | | i | | | m | ||||||||||
| | | | e | | | | | | | | | | g | | k | | |
| | d | | | | | | | | | | | | | | | | |
(1)表中所列元素中,属于短周期元素的有 (写元素符号),
e元素在元素周期表中的位置是 周期, 族。
(2)下列 组元素的单质可能都是电的良导体。
A、a, c, h B 、 i ,g, k C、c, h, m D、 d, e, f
(3)i元素属于 (填金属或非金属)元素,它的最高正化合价是
负化合价是 。它能跟氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用做干燥剂,写出它跟氧气反应的化学方程式: 。
(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。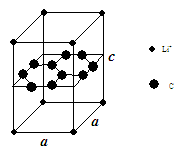
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
写出BeCO3分解的化学方程式 。
分解温度为什么越来越高? 。