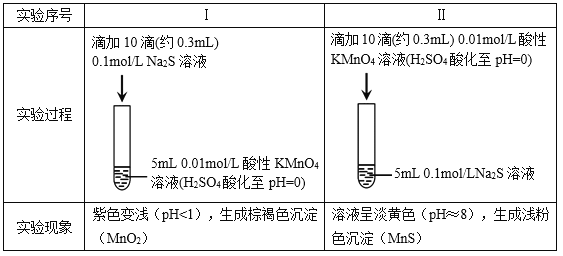
题目内容
【题目】某气态烃A,标准状况下的密度为1.25g/L,B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,E有香味。它们之间的转化关系如下图所示:
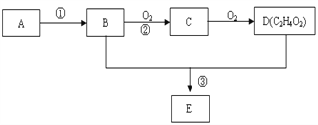
(1)A的电子式为______________,D中官能团的名称为__________。
(2)以A为原料自身合成高分子化合物的化学方程式为________________。
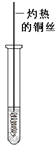
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如右图所示),重复操作2-3次,观察到的现象是铜丝由黑色变红色。 写出过程②反应方程式 _____________。
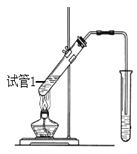
(4)B、D在浓硫酸的作用下实现反应③,实验装置如下图所示:
①试管1中实现反应③的化学方程式为_________________________________。
②反应开始时用酒精灯对试管小火加热的原因是:_______________________________。(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
【答案】 ![]() 羧基 nCH2 = CH2
羧基 nCH2 = CH2![]()
![]() CH2-CH2
CH2-CH2![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO + 2H2O CH3COOH+CH3CH2OH
2CH3CHO + 2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 防止由于温度过高使反应物来不及充分反应而被蒸出
CH3COOCH2CH3+H2O 防止由于温度过高使反应物来不及充分反应而被蒸出
【解析】已知气态烃A在标准状况下的密度为1.25g/L,则M(A)= 1.25g/L×22.4L/mol=28g/mol,D的分子式为C2H4O2,且能与碳酸氢钠反应,则D为乙酸,由此推知A为乙烯,B为乙醇,C为乙醛,E为乙酸乙酯。则
(1)A为乙烯,其电子式为![]() ,D中官能团的名称为羧基。
,D中官能团的名称为羧基。
(2)乙烯可通过自身加聚反应合成高分子化合物聚乙烯,化学方程式为nCH2 = CH2![]()
![]() CH2-CH2
CH2-CH2![]() 。
。
(3)在铜作催化剂的条件下,乙醇可氧化为乙醛,反应的方程式为2CH3CH2OH+O2![]() 2CH3CHO + 2H2O(或者写成两个:2Cu+O2
2CH3CHO + 2H2O(或者写成两个:2Cu+O2![]() 2CuO,CH3CH2OH+CuO
2CuO,CH3CH2OH+CuO![]() CH3CHO+Cu+H2O。
CH3CHO+Cu+H2O。
(4)在浓硫酸作用下,乙醇和乙酸反应生成乙酸乙酯,所以反应③的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;由于乙酸、乙醇以及乙酸乙酯都是易挥发性物质,为了防止反应物大量蒸发,使其充分反应,提高转化率,实验开始时要小火加热试管。
CH3COOCH2CH3+H2O;由于乙酸、乙醇以及乙酸乙酯都是易挥发性物质,为了防止反应物大量蒸发,使其充分反应,提高转化率,实验开始时要小火加热试管。