��Ŀ����
(12��)�Ȼ�������SO2Cl2����Ҫ�����Ȼ���������һ����ɫҺ�壬�۵㡪54.1�棬�е�69.1�棬��ˮ����������Ȼ��⡣�Ȼ��������ø���Ķ�������������ڻ���̿���������·�Ӧ��ȡ��SO2(g)��Cl2(g) SO2Cl2(l) ��H����97.3kJ/mol
SO2Cl2(l) ��H����97.3kJ/mol
��Ϊ�����������Ӧ��Cl2��ƽ��ת���ʣ����д�ʩ�������� ���ñ����գ���
(2)300��ʱ�����Ϊ1 L���ܱ������г���16.20 g SO2Cl2���ﵽƽ��ʱ�����к�SO2 7.616 g����300��ʱ�ϳ�SO2Cl2��Ӧ��ƽ�ⳣ��Ϊ ��
(3)��֪ij�¶��£���֪Ksp(AgCl)��2.0��10��10��Ksp(Ag2SO4)��1.6��10��5����SO2Cl2����ˮ������Һ����μ���AgNO3ϡ��Һ����Ag+Ũ��Ϊ0.1mol/Lʱ������Һ��Cl-Ũ����SO42-Ũ��֮��Ϊ ��
�Ƚ�(2)���õ�ƽ����������������BaCl2��Һ�У������������ɳ����������Ƕ��٣�д��������̣���
 SO2Cl2(l) ��H����97.3kJ/mol
SO2Cl2(l) ��H����97.3kJ/mol��Ϊ�����������Ӧ��Cl2��ƽ��ת���ʣ����д�ʩ�������� ���ñ����գ���
| A����С������� | B��ʹ�ô��� | C������SO2Ũ�� | D�������¶� |
(3)��֪ij�¶��£���֪Ksp(AgCl)��2.0��10��10��Ksp(Ag2SO4)��1.6��10��5����SO2Cl2����ˮ������Һ����μ���AgNO3ϡ��Һ����Ag+Ũ��Ϊ0.1mol/Lʱ������Һ��Cl-Ũ����SO42-Ũ��֮��Ϊ ��
�Ƚ�(2)���õ�ƽ����������������BaCl2��Һ�У������������ɳ����������Ƕ��٣�д��������̣���
��AC ��0.0706 (3��) (3) 1.25��10��6 (3��)
��SO2Cl2+2H2O=H2SO4+2HCl SO2+Cl2+2H2O=H2SO4+2HCl H2SO4+BaCl2=BaSO4��+2HCl
��SԪ�������غ㣬�ɵã�BaSO4�����ʵ���Ϊ0.12mol
������0.12mol��233g/mol=27.96g (4��)
��SO2Cl2+2H2O=H2SO4+2HCl SO2+Cl2+2H2O=H2SO4+2HCl H2SO4+BaCl2=BaSO4��+2HCl
��SԪ�������غ㣬�ɵã�BaSO4�����ʵ���Ϊ0.12mol
������0.12mol��233g/mol=27.96g (4��)
��1����С���������������Ũ������ѹǿ����ƽ�������ƶ��������Cl2��ƽ��ת���ʣ�ʹ�ô�������Ӱ��ƽ���ƶ����������Cl2��ƽ��ת���ʣ�����SO2Ũ�ȣ�ƽ�������ƶ��������Cl2��ƽ��ת���ʣ������¶ȣ�ƽ�������ƶ���Cl2��ƽ��ת���ʼ�С��
��2�� SO2(g)��Cl2(g) SO2Cl2(l)
SO2Cl2(l)
C(��ʼ) 0 0 0.12
��C 0.119 0.119 0.119
C��ƽ�⣩ 0.119 0.119 0.001
ƽ�ⳣ��K=0.001mol.L-1/(0.119 mol.L-1��0.119 mol.L-1)= 0.0706��mol.L-1��-1��
��3�� AgCl(S) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
Ksp(AgCl)��2.0��10��10=[Ag+][Cl-]����[Cl-]=2.0��10��9 mol.L-1
Ag2SO4(S) 2Ag+(aq)+SO42-( aq)
2Ag+(aq)+SO42-( aq)
Ksp(Ag2SO4)��1.6��10��5=[Ag+]2[SO42-] ����[SO42-]= 1.6��10��3mol.L-1
��[Cl-]��[SO42-]=1.25��10��6
��2�� SO2(g)��Cl2(g)
 SO2Cl2(l)
SO2Cl2(l)C(��ʼ) 0 0 0.12
��C 0.119 0.119 0.119
C��ƽ�⣩ 0.119 0.119 0.001
ƽ�ⳣ��K=0.001mol.L-1/(0.119 mol.L-1��0.119 mol.L-1)= 0.0706��mol.L-1��-1��
��3�� AgCl(S)
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq) Ksp(AgCl)��2.0��10��10=[Ag+][Cl-]����[Cl-]=2.0��10��9 mol.L-1
Ag2SO4(S)
 2Ag+(aq)+SO42-( aq)
2Ag+(aq)+SO42-( aq) Ksp(Ag2SO4)��1.6��10��5=[Ag+]2[SO42-] ����[SO42-]= 1.6��10��3mol.L-1
��[Cl-]��[SO42-]=1.25��10��6

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
�����Ŀ
 pC(g)���ﵽƽ��ʱ�����c(C)Ϊ0.5 mol��L-1�����¶Ȳ���������£��������������һ�������ﵽƽ��ʱ�����c(C)Ϊ0.3 mol��L-1���������ж���ȷ���ǣ� ��
pC(g)���ﵽƽ��ʱ�����c(C)Ϊ0.5 mol��L-1�����¶Ȳ���������£��������������һ�������ﵽƽ��ʱ�����c(C)Ϊ0.3 mol��L-1���������ж���ȷ���ǣ� �� 2SO3 ������һ������Ӧ���ȵĿ��淴Ӧ�������й�˵���д�����ǣ���
2SO3 ������һ������Ӧ���ȵĿ��淴Ӧ�������й�˵���д�����ǣ��� 2C(g)��2D��g������Ӧ���е�10sĩ�����A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol����
2C(g)��2D��g������Ӧ���е�10sĩ�����A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol����  C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)="0.100" mol��L-1,c(B)="0.200" mol��L-1, c(C)="0" mol��L-1����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ����
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)="0.100" mol��L-1,c(B)="0.200" mol��L-1, c(C)="0" mol��L-1����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ����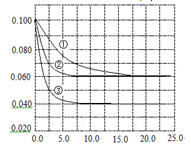
 PCl3(g)+Cl2(g)����H1>0 K1=10
PCl3(g)+Cl2(g)����H1>0 K1=10 2AB3������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ����ƽ��ʱA��ת������
2AB3������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ����ƽ��ʱA��ת������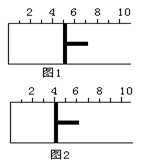
 1/2N2��g����CO2��g����H="-373.2" kJ/mol���ﵽƽ���Ϊ����߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ�Ĵ�ʩ��ȷ���ǣ� ��
1/2N2��g����CO2��g����H="-373.2" kJ/mol���ﵽƽ���Ϊ����߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ�Ĵ�ʩ��ȷ���ǣ� ��