��Ŀ����
����Ŀ���ס��ҡ���Ϊ�������ʡ�A��B��C��D��E��F��G��H��Ϊ��ѧ��ѧ�г����Ļ��������B��G����ɫ��Ӧ��Ϊ��ɫ��C��ʹƷ����Һ��ɫ����һ�������£��������ת����ϵ��ͼ��ʾ��
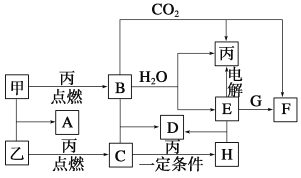
��ش��������⣺
��1���û�ѧʽ��ʾ����Ϊ__________��HΪ__________��
��2��A�ĵ���ʽΪ___________________��
��3�����E��ˮ��Һʱ��E��������_____________________
��4��д��B��C�D��D�Ļ�ѧ����ʽ__________________________
д��E��G�D��F�����ӷ���ʽ_______________________________
���𰸡�
��1��O2 SO3
��2�� ![]()
��3����ǿ��Һ�ĵ�������
��4��Na2O2��SO2===Na2SO4��2OH����CO2=== CO32-��H2O
��������
����������ס��ҡ���Ϊ�������ʣ�A��B��C��D��E��F��G��H��Ϊ��ѧ��ѧ�г����Ļ��������B��G����ɫ��Ӧ��Ϊ��ɫ��������NaԪ�أ�B���������̼��ˮ��Ӧ���ɵ��ʱ�����BΪNa2O2����ΪO2��AΪNa��EΪNaOH��FΪNa2CO3��G����ɫ��ӦΪ��ɫ�����������Ʒ�Ӧ�õ�̼���ƣ��ж�GΪNaHCO3��C��ʹƷ����Һ��ɫ���ɵ�������������Ӧ�õ�������ΪS��AΪNa2S��CΪSO2��HΪSO3��DΪNa2SO4��
��1��������������֪����ΪO2��HΪSO3���ʴ�Ϊ��O2��SO3��
��2��AΪNa2S������ʽΪ ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��3�����NaOH��ˮ��Һʱ��ʵ���ǵ��ˮ��NaOH�������ǣ���ǿ��Һ�����������ʴ�Ϊ����ǿ��Һ����������
��4��B+C��D�ǹ����������������Ӧ���������ƣ���Ӧ��ѧ����ʽΪ��Na2O2+SO2=Na2SO4��B��G���������ƺ�̼��������Һ�ķ�Ӧ����Ӧ�����ӷ���ʽΪ��HCO3-+OH-=CO32-+H2O���ʴ�Ϊ��Na2O2+SO2=Na2SO4��HCO3-+OH-=CO32-+H2O��

����Ŀ��Ϊ��̽��AgNO3�������Ժ����ȶ���,ij��ѧ��ȤС�����������ʵ�顣
��.AgNO3��������
����������˿����AgNO3��Һ��,һ��ʱ�����˿ȡ����Ϊ������Һ��Fe����������,����Һ�е�Ag+������,����������ʵ�顣��ѡ�õ��Լ�:KSCN��Һ��K3[Fe(CN)6]��Һ����ˮ��
��1��������±�:
���� | ���� | ���� |
ȡ��������Ag+�����Һ���Թ���,����KSCN��Һ,�� | �� | ����Fe3+ |
ȡ��������Ag+�����Һ���Թ���,������ ,�� | �� | ����Fe2+ |
��ʵ����ۡ�Fe����������ΪFe2+��Fe3+
��.AgNO3�����ȶ���
����ͼ��ʾ��ʵ��װ��A����AgNO3����,��������ɫ����,��װ��D���ռ�����ɫ���塣����Ӧ������,�Թ��в�������Ϊ��ɫ��

��2��װ��B�������� ��
��3����С�����۲���֤����ɫ����ΪO2,����֤������ ��
��4�����������ϡ�Ag2O�ͷ�ĩ״������Ϊ��ɫ;Ag2O�����ڰ�ˮ��
��������롿�Թ��в����ĺ�ɫ���������: ��.Ag; ��.Ag2O; ��.Ag��Ag2O��
��ʵ����֤����С��Ϊ��֤��������,�ֱ�ȡ������ɫ��������Թ���,����������ʵ�顣
ʵ���� | ���� | ���� |
a | ����������ˮ,�� | ��ɫ���岻�ܽ� |
b | ��������ϡ����,�� | ��ɫ�����ܽ�,����������� |
��ʵ�����ۡ���������ʵ��,����ȷ���������ɷֵ�ʵ���� (��ʵ����)��
��ʵ����ۡ���������ʵ����,д����С��ó�AgNO3�����ȷֽ�Ļ�ѧ����ʽ ��


