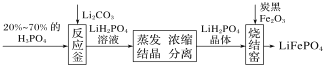
题目内容
【题目】有一含(NaOH 和 Na2CO3 或 Na2CO3 和 NaHCO3)混合碱,现称取试样 0.2960 克,以 0.1000mol·L-1的 HCl 标准溶液滴定,酚酞指示终点时消耗 20.00mL,再以甲基橙指示终点时,消耗盐酸为 VmL
(1)若 20.00<V<40.00 时,混合碱的组成为_______
(2)若 V>40.00,请列式计算以甲基橙指示终点时需要盐酸的体积为多少_______?
【答案】NaOH 和 Na2CO3 50.00mL
【解析】
滴定至第一滴定终点的过程中,发生反应是氢氧化钠和盐酸反应生成氯化钠溶液,碳酸钠和盐酸反应生成碳酸氢钠,酚酞试液由粉红色变成无色;第二滴定终点是继续滴入盐酸和碳酸氢钠反应生成氯化钠溶液,甲基橙溶液由黄色变为橙色;据此分析解答。
(1) 将0.1000mol/L HCl标准溶液滴定至第一滴定终点(此时得到的溶液中的溶质为NaCl和NaHCO3)时消耗 20.00mL,发生的反应可能为NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaHCO3+NaCl,然后再以甲基橙指示终点时,消耗盐酸为 VmL,发生的反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,若 20.00<V<40.00 时,说明第一滴定过程中消耗的盐酸溶液的体积小于20mL,则混合碱的组成为NaOH 和 Na2CO3,故答案为:NaOH 和 Na2CO3;
(2)若 V>40.00,说明混合碱的组成为Na2CO3 和 NaHCO3,根据第一滴定过程发生的反应Na2CO3+HCl=NaHCO3+NaCl和消耗 20.00mL0.1000mol/L HCl,n(Na2CO3)= 0.02000L×0.1000mol/L=0.002mol,则原混合物中含有碳酸氢钠为n(NaHCO3)= ![]() =0.001mol,因此第二滴定过程中发生的反应NaHCO3+HCl=NaCl+H2O+CO2↑,其中n(NaHCO3)= 0.001mol+0.002mol=0.003mol,因此消耗 0.1000mol/L HCl的体积V=
=0.001mol,因此第二滴定过程中发生的反应NaHCO3+HCl=NaCl+H2O+CO2↑,其中n(NaHCO3)= 0.001mol+0.002mol=0.003mol,因此消耗 0.1000mol/L HCl的体积V=![]() =30.00mL,因此前后共消耗0.1000mol/L HCl50.00mL,故答案为:50.00mL。
=30.00mL,因此前后共消耗0.1000mol/L HCl50.00mL,故答案为:50.00mL。

 阅读快车系列答案
阅读快车系列答案