题目内容
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )

A.原混合酸中NO物质的量浓度为2 mol/L
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol/L
D
【解析】向混合溶液中加入铜粉,反应为8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O,能溶解0.3 mol Cu,则HNO3的物质的量大于等于0.2 mol,可知OA段反应为4H++NO3-+Fe=Fe3++NO↑+2H2O,气体产物为NO,AB段反应为2Fe3++Fe=3Fe2+,说明A点时NO3-已反应完全,溶液中n(HNO3)=n(Fe)= =0.2 mol,c(HNO3)=
=0.2 mol,c(HNO3)=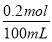 =2 mol/L,A项正确;BC段反应为Fe+2H+=Fe2++H2↑,B项正确;第二份溶液中NO3-已反应完全,故溶液中最终溶质为FeSO4,C项正确;c(H2SO4)=c(FeSO4)=
=2 mol/L,A项正确;BC段反应为Fe+2H+=Fe2++H2↑,B项正确;第二份溶液中NO3-已反应完全,故溶液中最终溶质为FeSO4,C项正确;c(H2SO4)=c(FeSO4)=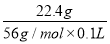 =4 mol/L,D项错误。
=4 mol/L,D项错误。

为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
| 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入________,振荡 |
| 存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
Ⅱ.AgNO3的热稳定性
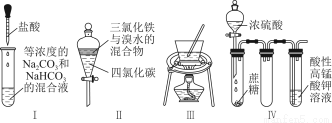
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
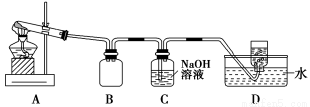
(2)装置B的作用是________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________。
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】 试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】 根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】 根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。